Увольнение работника из-за отказа переводиться на другую работу по медицинским показаниям. Разъясняет Аппарат прокуратуры области
18.05.2021г.
Разъясняет прокурор отдела по обеспечению участия прокуроров в гражданском процессе Т.М. Привороцкая.
Работника, нуждающегося в переводе на другую работу в соответствии с медицинским заключением, работодатель обязан перевести на другую имеющуюся у работодателя работу, не противопоказанную ему по состоянию здоровья (ч. 1 ст. 73 Трудового кодекса Российской Федерации (далее – ТК РФ).
Важными условиями для перевода является выдача заключения в порядке, установленном федеральными законами и иными нормативными правовыми актами Российской Федерации, а также наличие согласия работника на перевод, оформленного в письменном виде.
Порядок оформления и выдачи врачебной комиссией медицинского заключения о состоянии здоровья работника предусмотрен приказом Министерства Здравоохранения РФ от 28.01.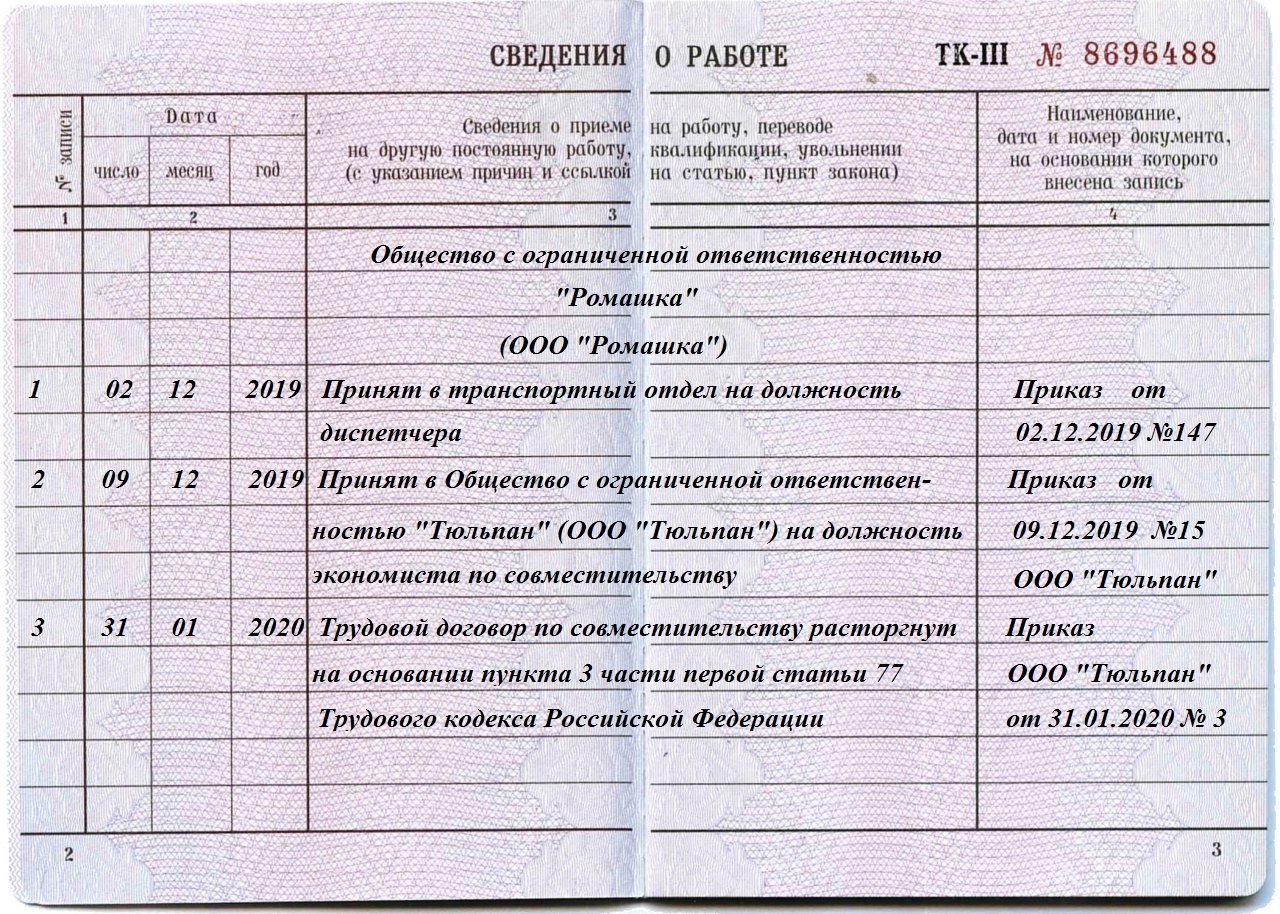 2021 № 29н «Об утверждении Порядка проведения обязательных предварительных и периодических медицинских осмотров работников, предусмотренных частью четвертой статьи 213 Трудового кодекса Российской Федерации, перечня медицинских противопоказаний к осуществлению работ с вредными и (или) опасными производственными факторами, а также работам, при выполнении которых проводятся обязательные предварительные и периодические медицинские осмотры», приказом Минздрава Свердловской области от 19.10.2007 № 963-п «Об организации деятельности врачебных комиссий в медицинских организациях Свердловской области».
2021 № 29н «Об утверждении Порядка проведения обязательных предварительных и периодических медицинских осмотров работников, предусмотренных частью четвертой статьи 213 Трудового кодекса Российской Федерации, перечня медицинских противопоказаний к осуществлению работ с вредными и (или) опасными производственными факторами, а также работам, при выполнении которых проводятся обязательные предварительные и периодические медицинские осмотры», приказом Минздрава Свердловской области от 19.10.2007 № 963-п «Об организации деятельности врачебных комиссий в медицинских организациях Свердловской области».
Если работник, нуждающийся в соответствии с медицинским заключением во временном переводе на другую работу, отказывается от предложенной работодателем работы или у работодателя отсутствует соответствующая работа, то работодатель обязан на весь указанный в медицинском заключении срок отстранить работника от работы с сохранением места работы (должности).
Если временный перевод на другую работу необходим работнику более чем на четыре месяца или работник нуждается в постоянном переводе на другую работу и работник отказывается от перевода либо у работодателя отсутствует соответствующая работа, то трудовой договор прекращается по п.
Особые правила установлены для работников, занимающих должности руководителей организаций (филиалов, представительств или иных обособленных структурных подразделений), их заместителей и главных бухгалтеров и нуждающихся в соответствии с медицинским заключением во временном или в постоянном переводе на другую работу.
Трудовой договор с такими работниками, в случае их отказа от перевода или при отсутствии у работодателя соответствующей работы, прекращается на основании ст.77 ТК РФ независимо от того, на какой срок в соответствии с медицинским заключением необходим им перевод на другую работу. Вместе с тем работодатель имеет право с письменного согласия указанных работников не прекращать с ними трудовой договор, а отстранить их от работы без сохранения заработной платы на срок, определяемый соглашением сторон.
При увольнении по указанному основанию работнику должно быть выплачено выходное пособие в размере двухнедельного среднего заработка (ч. 3 ст. 178 ТК РФ).
178 ТК РФ).
По указанному основанию не может быть уволена беременная женщина, поскольку согласно ч. 1 ст. 261 ТК РФ увольнение беременных женщин допускается только в случае ликвидации организации.
Согласно ст. 254 ТК РФ беременным женщинам в соответствии с медицинским заключением и по их заявлению снижаются нормы выработки, нормы обслуживания либо эти женщины переводятся на другую работу, исключающую воздействие неблагоприятных производственных факторов, с сохранением среднего заработка по прежней работе.
До предоставления беременной женщине другой работы, исключающей воздействие неблагоприятных производственных факторов, она подлежит освобождению от работы с сохранением среднего заработка за все пропущенные вследствие этого рабочие дни за счет средств работодателя.
Увольнение работника по п.8 ч.1 ст.77 ТК РФ не зависит от воли работодателя, поскольку в соответствии с ч.2 ст.212 ТК РФ работодатель обязан обеспечить недопущение работников к исполнению ими трудовых обязанностей в случае медицинских противопоказаний.
В соответствии с п.2.1. Определения Конституционного Суда РФ от 14.07.2011 № 887-О-О такое основание увольнения, как отказ работника от перевода на другую работу, необходимого ему в соответствии с медицинским заключением, или отсутствие у работодателя соответствующей работы, предусмотрено в целях недопущения выполнения работником работы, противопоказанной ему по состоянию здоровья, направлено на охрану здоровья работника и поэтому не может рассматриваться как нарушающее его права.
Вместе с тем с целью защиты права работника на труд работодатель обязан предложить все имеющиеся у него вакантные должности, которые он может занимать в соответствии со своим состоянием здоровья.
Нарушение работодателем предусмотренного законом порядка увольнения работника может являться основанием для признания увольнения незаконным в судебном порядке и восстановления его на работе.
Как предоставить отпуск: инструкция для кадровика
Три общих правила
Эти правила определены гл. 19 ТК РФ. О них часто забывают, между тем при проверке это может стать поводом для взыскания.
19 ТК РФ. О них часто забывают, между тем при проверке это может стать поводом для взыскания.
Правило 1. Работодатель обязан предоставлять сотрудникам оплачиваемый отпуск ежегодно (ст. 122 ТК РФ)
В нарушение этого правила руководители зачастую идут на поводу у сотрудников и предоставляют отпуск, только когда человек сам попросит. Если хотите соблюдать трудовое законодательство, варианта «работник не хочет идти в отпуск, переносит на следующий год» просто не должно быть.
Правило 2. Отдельным категориям сотрудников работодатель обязан предоставлять оплачиваемый отпуск в удобное для них время
К таким категориям относятся несовершеннолетние работники, почетные доноры России, родители трех и более детей в возрасте до 18 лет и пр. Когда будете составлять график отпусков на следующий год, возьмите с них заявление с пожеланием удобного времени отдыха. Но будьте готовы, что даже при наличии заявления сотрудник в любой момент может передумать и попросить отпуск в другое время.
Вопрос. Сотрудник — ветеран боевых действий попросил дать ему ежегодный отпуск с завтрашнего дня. Можно ли отказать со ссылкой на невозможность выплатить отпускные за три дня до начала?
Ответ. Работодатель обязан удовлетворить просьбу работника, так как законодатели не предусмотрели никаких исключений в порядке предоставления отпуска такой категории работников. Это подтверждает судебная практика (Определение Санкт-Петербургского городского суда от 13.02.2012 № 33-1972/2012, Апелляционное определение Московского городского суда от 14.05.2015 по делу № 33-8626).
Правило 3. Право на отпуск за первый год возникает после шести месяцев непрерывной работы у работодателя (ст. 122 ТК РФ). По этой причине не включайте в график на текущий календарный год сотрудников, которые только поступили на работу. Чтобы отпустить новичка в отпуск после шести месяцев работы, вам потребуется только взять с него заявление. Впрочем, по договоренности с работодателем сотрудник может отдохнуть и раньше.
Впрочем, по договоренности с работодателем сотрудник может отдохнуть и раньше.
Алгоритм предоставления ежегодного оплачиваемого отпуска по графику отпусков
Составить и утвердить график отпусков
Согласно ст. 123 ТК РФ очередность предоставления оплачиваемых отпусков определяет ежегодный график отпусков. Работодатель утверждает документ с учетом мнения выборного органа первичной профсоюзной организации. Если профсоюза нет — единолично. График нужно утвердить не позднее чем за две недели до начала календарного года. Вы можете использовать унифицированную форму Т-7 или разработать свою.
- Предупреждаем риски. Если в графе 5 «Количество календарных дней» указана лишь часть от положенного отпуска, возьмите с работника письменное согласие как доказательство достигнутого соглашения сторон (ст. 125 ТК РФ). Оптимальным вариантом будет заявление с просьбой в следующем календарном году разделить оплачиваемый отпуск на части с указанием продолжительности каждой.

Заявление должно быть оформлено до даты утверждения графика отпусков. Это важно, потому что понятия «ознакомлен» и «согласен» влекут за собой разные правовые последствия. График отпусков — это локальный акт, который работодатель утверждает в одностороннем порядке. Недостаточно просто ознакомить с ним сотрудника, важно заручиться его согласием до утверждения графика.
Заявление от работника о предоставлении части ежегодного отпуска и дальнейшее ее предоставление работодателем рассматривается судьями как доказательство соглашения между работником и работодателем (Решение Пермского краевого суда от 19.04.2017 по делу № 7-674-2017(21-421/2017).
Чек-лист. На что обращают внимание инспекторы ГИТ при проверке графика отпусков:
| Дата утверждения графика отпусков | Не позднее чем за две недели до начала календарного года | ч. 1 ст. 123 ТК РФ |
| Оплачиваемый отпуск на основании графика | Планируется и используется фактически полностью | ст. 123, 124 ТК РФ 123, 124 ТК РФ |
| Планируется и (или) используется частями на основании достигнутого соглашения сторон, одна из частей — не менее 14 календарных дней | ст. 125 ТК РФ | |
| Ознакомление с графиком отпусков | С графиком отпусков работник ознакомлен под роспись | Письмо Роструда от 01.08.2012 № ПГ/5883-6-1 |
Ознакомить сотрудников с графиком отпусков под роспись
С одной стороны, в ТК РФ нет нормы, обязывающей работодателя знакомить работников с графиком отпусков под роспись. С другой, специалисты Роструда в Письме от 01.08.2012 № ПГ/5883-6-1 квалифицировали график отпусков как локальный нормативный акт и потребовали выполнения нормы ст. 22 ТК РФ. Актуальная инспекционная и судебная практика подтверждают такой подход: Постановление Верховного Суда РФ от 01.11.2018 № 3-АД18-7, Постановление Калининградского областного суда от 22.04.2016 № 4А-170/2016, Решение Белгородского областного суда от 29.
Как можно ознакомить с графиком отпусков:
- Дополнить унифицированную форму Т-7 графой 11, в которой после утверждения графика сотрудники будут ставить свои подписи.
- Разработать отдельный лист ознакомления к графику отпусков.
Известить сотрудника о времени начала отпуска
Форма извещения трудовым законодательством не уточнена, но определены два условия (Письмо Роструда от 30.07.2014 № 1693-6-1). Сотруднику нужно сообщить о начале отпуска:
- не позднее чем за две недели;
- под роспись.
При этом форма документа может быть любая:
- извещения в двух экземплярах: один — работнику, второй с отметкой и подписью работника о получении экземпляра — работодателю;
- служебная записка;
- собственная форма графика отпусков с графой 11 «О времени начала отпуска извещен. Дата. Подпись» и пр.
Последний вариант позволяет убить двух зайцев: известить о начале отпуска и подтвердить, что работник ознакомлен с графиком.
Главное, при выборе способов извещения понимать, что если вы не выполните два основных условия, организацию могут привлечь к административной ответственности по ч. 1 ст. 5.27 КоАП РФ.
- Предупреждаем риски. Если отпуск предоставляется в соответствии с графиком отпусков, работник не пишет заявление на отпуск. Это обязанность работодателя известить его. Заявления на отпуск появляются, когда есть отклонения от графика, например, работник хочет отгулять лишь часть отпуска или возникли законные обстоятельства для его переноса.
Издать приказ о предоставлении отпуска и ознакомить с ним работника под роспись
В настоящее время нет ни одного нормативного правового акта, обязывающего работодателей издавать приказ на отпуск. Но на практике большая часть компаний его оформляют. К этому привыкли и проверяющие из ГИТ. Известны случаи, когда работодателей привлекали к ответственности за отсутствие приказа на отпуск или за неознакомление с ним работника. Нельзя сказать, что такая практика правомерна, но она существует (Решение Московского городского суда от 08.02.2019 по делу № 7-648/2019, Решение Верховного Суда РФ от 01.03.2017 № 84-АД17-1).
Нельзя сказать, что такая практика правомерна, но она существует (Решение Московского городского суда от 08.02.2019 по делу № 7-648/2019, Решение Верховного Суда РФ от 01.03.2017 № 84-АД17-1).
Поэтому если вы решили оптимизировать кадровое делопроизводство и исключить приказ о предоставлении отпуска из документооборота, учитывайте и такой вариант развития событий.
Для оформления и учета отпусков есть унифицированные формы № Т-6 «Приказ (распоряжение) о предоставлении отпуска работнику» и № Т-6а «Приказ (распоряжение) о предоставлении отпуска работникам» ( Постановление Госкомстата России от 05.01.2004 №1), но вы можете разработать свою форму.
Основанием для приказа является сам график отпусков. В приказе укажите номер и дату, табельный номер, ФИО, должность работника, структурное подразделение, рабочий год, за который предоставляется отпуск.
Рабочий год исчисляется с даты приема на работу, но всегда проверяйте себя: могут быть периоды, которые сдвинут окончание рабочего года.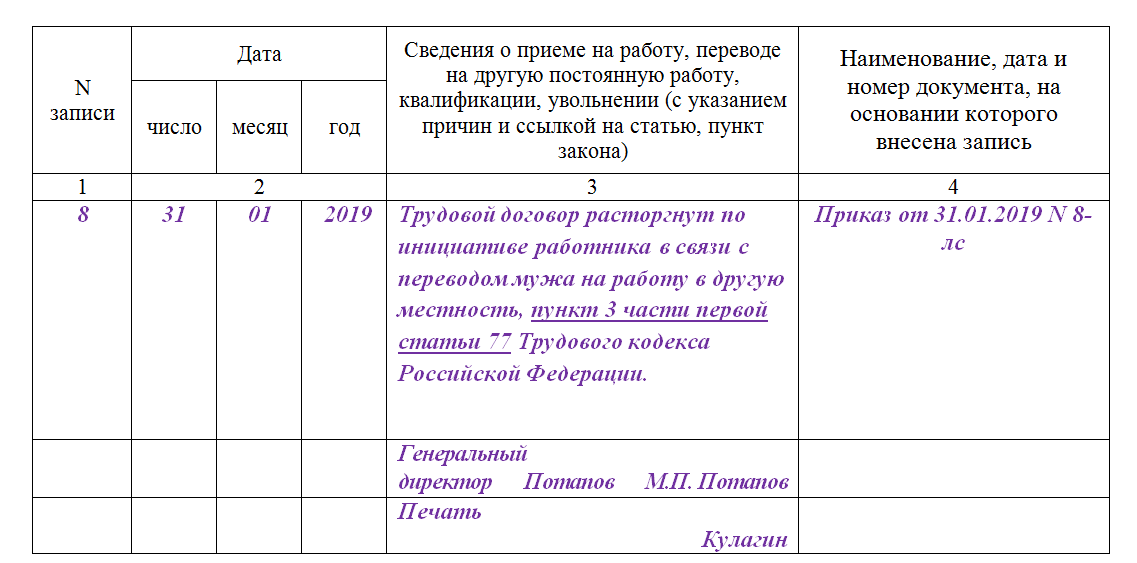
Вопрос. Если работник принят на работу 1 июня 2020 года, в декабре 2020-го он находился 20 дней в отпуске без содержания, как определить рабочий год для исчисления ежегодного оплачиваемого отпуска?
Ответ. Если работнику предоставлялось 20 дней отпуска без сохранения заработной платы в декабре, то окончание первого рабочего года сдвинется на 6 дней: из 20 дней отпуска без сохранения в рабочий год включаются 14 дней, а окончание отпуска сдвигается на 6 календарных дней (ч. 1 ст. 121 ТК РФ, Письмо Роструда от 14.06.2012 № 854-6-1). Таким образом, первый год закончится не 31 мая, а 6 июня 2021 года. Соответственно, второй рабочий год начнется с 7 июня 2021 года и закончится 6 июня 2022 года.
Срок издания приказа на отпуск законодательством не установлен. Учитывайте время, необходимое для подписания, передачи в бухгалтерию и пр.
Оформить записку-расчет о предоставлении отпуска работнику
Курсы для кадровика
Повышение квалификации, профпереподготовка. Онлайн-тесты. Удостоверения и дипломы
Онлайн-тесты. Удостоверения и дипломы
Записка-расчет — необязательный документ, но зачастую она необходима для расчета причитающихся работнику отпускных. Решая вопрос, надо или нет составлять ее, ориентируйтесь на внутренние правила своего работодателя.
Вы можете использовать унифицированную форму
№ Т-60 (Постановление Госкомстата России от 05.01.2004 № 1) или разработать свою. Важно оформить записку-расчет заранее, чтобы бухгалтерия успела выплатить отпускные работнику в срок — не позднее чем за три дня до начала отпуска.
Работники кадровых служб заполняют только первый лист записки-расчета, вносят номер и дату составления записки-расчета, табельный номер, ФИО, должность работника, структурное подразделение, в котором он работает, и период работы, за который предоставляется отпуск. Второй лист содержит расчет оплаты отпуска, начислений и удержаний, а также общей суммы к выплате и заполняется бухгалтерией.
Записка-расчет — это внутренний документ, который необходим только для взаимодействия кадровой службы и бухгалтерии. Ее не нужно выдавать работнику, поэтому оформлять можно только в электронном виде.
Ее не нужно выдавать работнику, поэтому оформлять можно только в электронном виде.
Выплатить работнику отпускные
В соответствии с ч. 9 ст. 136 ТК РФ оплата отпуска производится не позднее чем за три дня до его начала. Речь идет именно о календарных днях. Если отпуск начинается в понедельник, последний день для выплаты отпускных — четверг (Письмо Роструда от 14.05.2020 № ПГ/20884-6-1, Письмо Минтруда России от 05.09.2018 № 14-1/ООГ-7157).
Внести сведения об отпуске в личную карточку работника
После 1 сентября 2021 года вопрос, вести или нет личные карточки Т-2 для кадрового учета, работодатель может решить самостоятельно. Единственный нормативный правовой акт, обязывающий вести личные карточки на бумажном носителе, — Постановление Правительства РФ от 16.04.2003 № 225 — с 1 сентября утрачивает силу в связи с Постановлением Правительства РФ от 24.07.2021 № 1250.
Обратите внимание: личная карточка — это единственный документ в кадровом делопроизводстве для учета сведений о предоставляемых отпусках.
Если вы продолжаете их заполнять, то в разделе VIII указывайте вид отпуска — «ежегодный основной оплачиваемый», период работы, за который он предоставляется, количество календарных дней, даты начала и окончания, а также основание — реквизиты приказа об отпуске. С записью в личной карточке знакомить сотрудника не нужно.
Работодатели должны продолжать вести личные карточки Т-2 для целей воинского учета. Минобороны пока не утвердил новую форму.
Внести сведения об отпуске в табель учета рабочего времени
Работодатель обязан вести учет фактически отработанного сотрудниками времени (ст. 91 ТК РФ). Если для этого вы используете унифицированные формы № Т-12 или № Т-13, дни ежегодного основного оплачиваемого отпуска работника отметьте буквенным кодом «ОТ» или цифровым «09».
Внести в график отпусков данные о фактически использованных днях отпуска
Если вы используете унифицированную форму графика отпусков № Т-7, дату фактического начала отпуска ставьте в графе 7. Не надо ждать окончания года, заполняйте в режиме реального времени.
Не надо ждать окончания года, заполняйте в режиме реального времени.
Если фактическая дата отличается от планируемой, обязательно в графе 8 укажите документ, на основании которого отпуск переносится, а в графе 9 — дату переноса отпуска.
Даты могут отличаться только по причинам, названным в ст. 124 ТК РФ, и в случае, когда работник просит предоставить часть отпуска (ст. 125 ТК РФ).
Вместо заключения
Предоставление отпуска требует от кадрового сотрудника знания трудового законодательства и соблюдения определенной последовательности действий.
Главное правило: нельзя нарушать обязательные требования, предусмотренные законодательством. Серьезными нарушениями будет отказаться от графика отпусков или утверждать его позже чем за две недели до начала календарного года, не извещать сотрудников о начале отпуска или не предоставлять отпуск в полном размере. В этих случаях работодатель может быть привлечен к административной ответственности по ч. 1 ст. 5.27 КоАП РФ.
Подробная инструкция поможет оформлять ежегодные отпуска без ошибок, а приведенный ниже чек-лист — проверить себя.
Порядок предоставления основного оплачиваемого отпуска согласно графику
| Работник извещен о времени начала отпуска под роспись не позднее чем за две недели до его начала | ч. 3 ст. 123 ТК РФ |
| Издан приказ о предоставлении отпуска, с которым работник ознакомлен под роспись | сложившаяся практика |
| Работнику выплачены отпускные не позднее чем за три дня до начала отпуска | ч. 9 ст. 136 ТК РФ |
| Заполнена графа 7 «Дата фактическая» графика отпусков, она совпадает с графой 6 «Дата запланированная» | ч. 2 ст. 123, ч. 2 ст. 124 ТК РФ |
| Заполнен раздел VIII «Отпуска» личной карточки Т-2 | с 01.09.2021 г. необязательно |
| За дни нахождения в отпуске в табеле проставляется соответствующий код | ст. 91 ТК РФ 91 ТК РФ |
Шпаргалка
В шпаргалке собрана полезная информация из статьи:
-
График отпусков 55 КБ
-
Заявление на деление отпуска на части 658.6 КБ
-
Личная карточка сотрудника 666.9 КБ
-
Приказ о предоставлении отпуска 687.4 КБ
Статья 72.
 1 ТК РФ. Перевод на другую работу. Перемещение. Комментарии
1 ТК РФ. Перевод на другую работу. Перемещение. КомментарииВ статье 72.1 ТК изложены основные нюансы перемещения/перевода сотрудника на другую позицию. В ней приведено определение понятия перевода, описаны необходимые для него действия, а также указаны ограничения по его использованию нанимателем.
Трудовой кодекс Российской Федерации от 30.12.2001 N 197-ФЗ
Содержание ст. 72.1 ТК
В её начале даётся определение перевода. Указывается, что он может иметь следующие формы:
- изменение трудовой функции;
- и/или соответствующее изменение в подразделении, где задействован работник, если оно упоминается в трудовом договоре;
- или перевод внутри организации на иную территорию.
Подчёркнуто, что во всех вариантах сотрудник должен продолжать числиться у того же нанимателя.
Указано, что в любом из трёх упомянутых форматов перевод возможен лишь на основе письменного подтверждения служащего. Исключения касаются ситуаций, разобранных в ст. 72.2 ТК.
72.2 ТК.
Разобран и случай, когда сотрудник высказывает желание перевестись к другому нанимателю на работу постоянного характера. Это возможно по просьбе или с согласия сотрудника. В этой ситуации трудовой договор с прежним нанимателем прекращает действие по ч. 1. ст. 77 ТК. В обоих случаях от желающего перевестись работника требуется оформить своё мнение в письменной форме.
Далее разбираются ситуации с перемещением. Оно отличается тем, что нанимателю не нужно согласие подчинённого. Это возможно, если подчинённый:
- перемещается на другое место у того же нанимателя;
- перемещается в подразделение организации, территориально находящееся в той же местности;
- начинает трудиться на оборудовании, близком к тому, на котором он работал ранее.
Также необходимо, чтобы всё вышеперечисленное не влекло изменения параметров актуального трудового договора.
В заключительной части подчёркивается, что нанимателю запрещается переводить/перемещать подчинённого на должность, которая противопоказана для него по медицинским показателям.
Итак, рассмотренная статья подробно разбирает основные моменты, связанные с переводом/перемещением сотрудника, и определяет, какие ограничения действуют по реализации этих возможностей на практике.
Вопросы по аспектам применения ст. 72.1 ТК
Как можно отличить перевод сотрудника от его перемещения?
Отличия ясно расписаны в рассмотренной статье. Итак, перевод возникает, если:
- наниматель перемещает подчинённого на другую позицию, вследствие чего возникает изменение его должностной функции;
- в подразделении, где действует подчинённый, возникают значимые изменения, затрагивающие трудовую сферу;
- наниматель перемещает подчинённого на другую территорию.
Перемещением являются ситуации, когда:
- подчинённый переходит на другое рабочее место, без изменения его должностных обязанностей;
- подчинённый переходит на подобную позицию в другое местное подразделение;
- подчинённый начинает трудиться на оборудовании, близком к тому, на котором он ранее работал.

Ключевым в их различии является изменение понятий, заранее прописанных сторонами в трудовом договоре. Если они меняются, то речь идёт о переводе. В противном случае – о перемещении.
Какие особенности перевода подчинённого в другое территориальное подразделение нужно учитывать руководителю?
В первую очередь необходимо помнить, что наниматель обязан компенсировать подчинённому затраты на переезд (ст. 169 ТК). Также необходимо понимать, что именно считается другой территорией – для этого нужно изучить Постановление Пленума ВС №2 от 17.03.04. В части 3 этого Постановления как раз рассмотрено понятие другой местности с точки зрения трудового права – оно определено, как территория за пределами установленных границ данного населённого пункта. Помимо этого, руководству нужно иметь в виду, что подчинённый может вовсе отказаться от такого перевода, прекратив трудовые отношения, на что указывает ст. 77 ТК.
Перевод или перемещение по рассматриваемой статье происходят по инициативе нанимателя?
Не обязательно, т. к. подчинённый вправе обратиться к руководству с соответствующей просьбой. Но она рассматривается менеджером именно как предложение, которое он может как удовлетворить, так и отказать в его выполнении. Исключения возможны в ситуациях, которые особо рассмотрены в ТК. Так, как указывает ст. 220 ТК, наниматель обязан обеспечить подчинённого новой работой, если на прежней невозможно трудиться из-за опасностей для жизни/здоровья.
к. подчинённый вправе обратиться к руководству с соответствующей просьбой. Но она рассматривается менеджером именно как предложение, которое он может как удовлетворить, так и отказать в его выполнении. Исключения возможны в ситуациях, которые особо рассмотрены в ТК. Так, как указывает ст. 220 ТК, наниматель обязан обеспечить подчинённого новой работой, если на прежней невозможно трудиться из-за опасностей для жизни/здоровья.
Статья ТКРФ 72.2. Временный перевод на другую работу
Комментарий к статье 72.2
1. Общий принцип стабильности трудового правоотношения (см. ст. ст. 60, 72 и комментарий к ним) распространяет свое действие и на случаи временных переводов на другую работу. Это означает, что, как правило, изменение содержания трудовой функции и (или) обусловленного договором места применения труда осуществляется исключительно по соглашению сторон, заключаемому в письменной форме (о форме соглашения при переводе см. п. 4 комментария к ст. 72 ТК).
Вместе с тем законодателем устанавливаются некоторые дополнительные правила императивного характера, связанные с обеспечением принципа стабильности трудового правоотношения. В силу ч. 1 ст. 72.2 если по окончании срока перевода прежняя работа работнику не предоставлена, а он не потребовал ее предоставления и продолжает работать, то условие о временном характере перевода утрачивает силу и перевод считается постоянным. Таким образом, сам факт допуска работника к работе после наступления даты, обозначенной в соглашении о переводе в качестве момента окончания срока перевода, означает достижение сторонами нового соглашения о том, что новая работа является для работника постоянной. Применительно к переводу для замещения временно отсутствующего работника такое соглашение презюмируется для случая, когда этот работник вышел на работу и в то же время переведенный работник также не освобожден от исполнения работы по переводу.
В силу ч. 1 ст. 72.2 если по окончании срока перевода прежняя работа работнику не предоставлена, а он не потребовал ее предоставления и продолжает работать, то условие о временном характере перевода утрачивает силу и перевод считается постоянным. Таким образом, сам факт допуска работника к работе после наступления даты, обозначенной в соглашении о переводе в качестве момента окончания срока перевода, означает достижение сторонами нового соглашения о том, что новая работа является для работника постоянной. Применительно к переводу для замещения временно отсутствующего работника такое соглашение презюмируется для случая, когда этот работник вышел на работу и в то же время переведенный работник также не освобожден от исполнения работы по переводу.
Следует обратить внимание на то, что данное правило применяется и к тем случаям, когда изменение трудовой функции выразилось в возложении на работника выполнения работ по иной должности, специальности или профессии без освобождения от прежней работы, т. е. в случаях совмещения профессий, должностей или расширении зоны обслуживания (см. ст. 60.2 ТК и комментарий к ней).
е. в случаях совмещения профессий, должностей или расширении зоны обслуживания (см. ст. 60.2 ТК и комментарий к ней).
Поскольку в ч. 1 ст. 72.2 устанавливаются правила временного перевода на другую работу у того же работодателя, эти правила не распространяются на случаи временного перевода работника к другому работодателю. Следовательно, в последнем случае не требуется в силу закона обязательного письменного оформления соглашения о переводе (хотя письменная форма является целесообразной), исключительно соглашением сторон определяются условия перевода, включая и условие о его продолжительности; соответственно, не действует и правило, установленное указанной статьей относительно трансформации временного перевода в постоянный. В случае если возникнет потребность перехода работника на работу к работодателю по месту перевода, такой переход должен осуществляться по правилам увольнения в порядке перевода к другому работодателю либо путем увольнения работника по собственному желанию с последующим заключением трудового договора с новым работодателем.
2. Работодатель вправе переводить работника на не обусловленную трудовым договором работу для предотвращения экстраординарных случаев, указанных в ч. ч. 2 и 3 ст. 72.2, либо устранения их последствий. В связи с этим Верховный Суд РФ указывает (п. 17 Постановления Пленума от 17 марта 2004 г. N 2), что при применении ч. ч. 2 и 3 ст. 72.2 Кодекса, допускающих временный перевод работника на другую работу без его согласия, судам следует иметь в виду, что обязанность доказать наличие обстоятельств, с которыми закон связывает возможность такого перевода, возлагается на работодателя.
Перевод на другую работу в указанных случаях регламентируется федеральным законом, поэтому право работодателя осуществить такой перевод, как и обязанность работника выполнять новую работу, вытекает непосредственно из закона, вне зависимости от того, предусмотрено ли это в качестве условия трудового договора. При этом под работой, не обусловленной трудовым договором, понимается работа, которая может находиться за рамками трудовой функции, обусловленной трудовым договором.
Рассматриваемый перевод относится к категории переводов, осуществляемых по инициативе работодателя (см. п. 6 комментария к ст. 72.1 ТК). Отказ работника от перевода является дисциплинарным проступком, влекущим дисциплинарную ответственность.
Поскольку указанная внедоговорная обязанность чревата возникновением феномена принудительного труда, законодатель обставляет ее реализацию рядом внедоговорных организационно-правовых условий.
Перевод в порядке ст. 72.2 ТК: а) возможен при наличии фактических обстоятельств экстраординарного характера; б) является временным; в) может быть осуществлен только у того же работодателя; г) допускается при сохранении за работником права на труд определенного качества.
3. Перечень случаев экстраординарного характера, являющихся основанием для перевода работника, приводится в ч. ч. 2 и 3 ст. 72.2 ТК. Если работодатель осуществил перевод работника под предлогом производственной необходимости при отсутствии исключительных случаев, свидетельствующих о реальной необходимости такого перевода, он признается незаконным.
Судебная практика исходит из того, что рассматриваемый перевод возможен, если у работодателя отсутствовала возможность иным путем предотвратить или ликвидировать указанные в ст. 72.2 причины. Недостатки в организации труда не могут служить основанием для такого перевода.
4. Перевод в порядке ст. 72.2 ТК допускается на срок не более одного месяца. Поскольку законом ограничивается лишь предельный срок, но не число переводов, такой перевод может иметь место неоднократно, однако всякий раз при наличии соответствующей причины исключительного характера.
Если действие причины, обусловившей рассматриваемый перевод, продолжается более месяца, работнику может быть поручено выполнение работы за пределами обусловленной трудовой функции или места работы (структурного подразделения) при условии получения на это его согласия.
5. В соответствии с действующим Кодексом рассматриваемый перевод допускается исключительно у данного работодателя. При этом не имеет значения то, что обстоятельство, обусловившее такой перевод, может возникнуть у другого хозяйствующего субъекта.
Временный перевод к другому работодателю для устранения указанных обстоятельств возможен только с согласия переводимого работника.
В то же время следует обратить внимание на то, что законодатель никак не ограничивает возможность перевода в связи с обстоятельствами, указанными в комментируемой статье, в подразделение организации работодателя, находящееся в другой местности, в том числе в обособленное структурное подразделение.
6. При переводе в порядке ст. 72.2 ТК работнику не может быть поручена работа, противопоказанная ему по состоянию здоровья.
Поручение переводимому работнику работы более низкой квалификации по сравнению с обусловленной трудовым договором возможно только с письменного согласия работника.
7. Перевод для замещения временно отсутствующего работника является частным случаем временных переводов рассматриваемого вида. В отличие от ранее действовавшего порядка в настоящее время он осуществляется на основании общих правил, установленных для временных переводов ст. 72.2 ТК.
72.2 ТК.
8. Перевод на другую работу в случаях, указанных в ст. 72.2 ТК, оформляется приказом (распоряжением) работодателя, в котором должны быть указаны основание и срок перевода, поручаемая работнику работа и условия оплаты труда (по выполняемой работе, но не ниже среднего заработка по прежней работе).
9. Приказ работодателя о переводе обязателен для работника, и необоснованный отказ от него является дисциплинарным проступком, влекущим дисциплинарную ответственность.
В том случае, когда работник не выходит на работу либо выходит к прежнему рабочему месту, такие его действия должны рассматриваться как прогул. Если же работник выходит на новое рабочее место, отказываясь при этом выполнять соответствующую работу, подобные действия следует трактовать как длящееся дисциплинарное правонарушение, за которое может быть объявлено несколько дисциплинарных взысканий, включая увольнение за неоднократное неисполнение трудовых обязанностей (п. 5 ст. 81 ТК).
Вместе с тем следует учитывать, что в силу абз.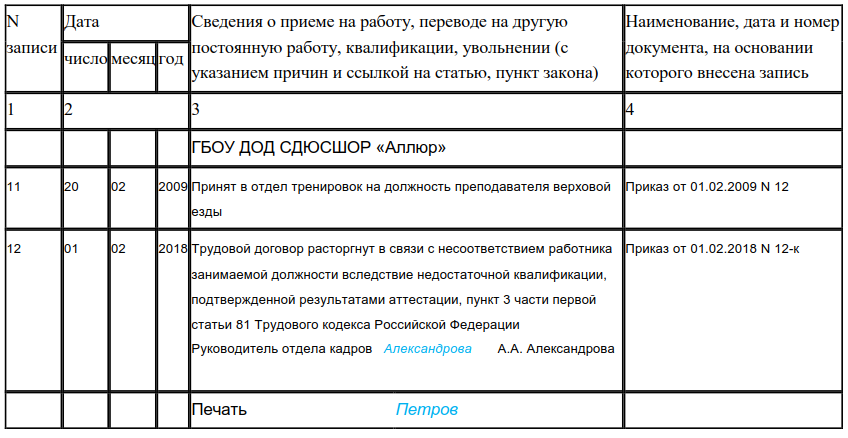 5 ст. 219, ч. 7 ст. 220 ТК работник не может быть подвергнут дисциплинарному взысканию за отказ от выполнения работ в случае возникновения опасности для его жизни и здоровья вследствие нарушения требований охраны труда, за исключением случаев, предусмотренных федеральными законами, до устранения такой опасности либо от выполнения тяжелых работ и работ с вредными и (или) опасными условиями труда, не предусмотренных трудовым договором. Поскольку Кодекс не содержит норм, запрещающих работнику воспользоваться названным правом и тогда, когда выполнение таких работ вызвано переводом по основаниям, указанным в ст. 72.2 Кодекса, отказ работника от временного перевода на другую работу в порядке ст. 72.2 Кодекса по указанным выше причинам является обоснованным (п. 19 Постановления Пленума Верховного Суда РФ от 17 марта 2004 г. N 2).
5 ст. 219, ч. 7 ст. 220 ТК работник не может быть подвергнут дисциплинарному взысканию за отказ от выполнения работ в случае возникновения опасности для его жизни и здоровья вследствие нарушения требований охраны труда, за исключением случаев, предусмотренных федеральными законами, до устранения такой опасности либо от выполнения тяжелых работ и работ с вредными и (или) опасными условиями труда, не предусмотренных трудовым договором. Поскольку Кодекс не содержит норм, запрещающих работнику воспользоваться названным правом и тогда, когда выполнение таких работ вызвано переводом по основаниям, указанным в ст. 72.2 Кодекса, отказ работника от временного перевода на другую работу в порядке ст. 72.2 Кодекса по указанным выше причинам является обоснованным (п. 19 Постановления Пленума Верховного Суда РФ от 17 марта 2004 г. N 2).
Комментарии к Трудовому кодексу Российской Федерации
Издательский Дом «Городец», 2007
Источник: СПС Консультант
Работник стал инвалидом – увольнение или перевод на другую работу?
Если сотруднику была установлена инвалидность и ему противопоказана любая трудовая деятельность, работодатель должен расторгнуть с ним трудовой договор на основании п. 5 ч. 1 ст. 83 ТК РФ, в котором сказано, что трудовой договор подлежит прекращению по обстоятельствам, не зависящим от воли сторон, при признании работника полностью неспособным к трудовой деятельности в соответствии с медицинским заключением, выданным в порядке, установленном федеральными законами и иными нормативными правовыми актами РФ. Документом — основанием для увольнения по п. 5 ч. 1 ст. 83 ТК РФ является справка медико-социальной экспертизы.
5 ч. 1 ст. 83 ТК РФ, в котором сказано, что трудовой договор подлежит прекращению по обстоятельствам, не зависящим от воли сторон, при признании работника полностью неспособным к трудовой деятельности в соответствии с медицинским заключением, выданным в порядке, установленном федеральными законами и иными нормативными правовыми актами РФ. Документом — основанием для увольнения по п. 5 ч. 1 ст. 83 ТК РФ является справка медико-социальной экспертизы.Кроме того, работодателю необходимо учитывать положения ст. 184 ТК РФ, в которой сказано, что при повреждении здоровья или в случае смерти работника вследствие несчастного случая на производстве либо профессионального заболевания работнику (его семье) возмещаются утраченный им заработок (доход), а также связанные с повреждением здоровья дополнительные расходы на медицинскую, социальную и профессиональную реабилитацию либо соответствующие расходы в связи со смертью работника.
Если сотруднику установлена инвалидность и ему необходим более легкий труд, согласно ч. 3 ст. 73 ТК РФ, если в соответствии с медицинским заключением работник нуждается во временном переводе на другую работу на срок более четырех месяцев или в постоянном переводе, при его отказе от перевода либо отсутствии у работодателя подходящей работы трудовой договор с ним прекращается по п. 8 ч. 1 ст. 77 ТК РФ. В этом пункте указано, что основанием для прекращения трудового договора является, в частности, отказ работника от перевода на другую работу, необходимого ему в соответствии с медицинским заключением, выданным в порядке, предусмотренном федеральными законами и иными нормативными правовыми актами РФ, либо отсутствие у работодателя соответствующей работы (ч. 3 и 4 ст. 73 ТК РФ). При этом увольняемому работнику в таком случае выплачивается выходное пособие в размере двухнедельного среднего заработка (ч. 3 ст. 178 ТК РФ).
3 ст. 73 ТК РФ, если в соответствии с медицинским заключением работник нуждается во временном переводе на другую работу на срок более четырех месяцев или в постоянном переводе, при его отказе от перевода либо отсутствии у работодателя подходящей работы трудовой договор с ним прекращается по п. 8 ч. 1 ст. 77 ТК РФ. В этом пункте указано, что основанием для прекращения трудового договора является, в частности, отказ работника от перевода на другую работу, необходимого ему в соответствии с медицинским заключением, выданным в порядке, предусмотренном федеральными законами и иными нормативными правовыми актами РФ, либо отсутствие у работодателя соответствующей работы (ч. 3 и 4 ст. 73 ТК РФ). При этом увольняемому работнику в таком случае выплачивается выходное пособие в размере двухнедельного среднего заработка (ч. 3 ст. 178 ТК РФ).
При увольнении работника до окончания того рабочего года, в счет которого он уже получил ежегодный оплачиваемый отпуск, за неотработанные дни отпуска выплаты не производятся, если работник увольняется по основаниям, предусмотренным п. 8 ч. 1 ст. 77 или п. 5 ч. 1 ст. 83 ТК РФ (абз. 5 ч. 2 ст. 137 ТК РФ).
8 ч. 1 ст. 77 или п. 5 ч. 1 ст. 83 ТК РФ (абз. 5 ч. 2 ст. 137 ТК РФ).
Согласно ст. 182 ТК РФ при переводе работника, нуждающегося в соответствии с медицинским заключением, выданным в порядке, установленном федеральными законами и иными нормативными правовыми актами РФ, в предоставлении другой работы, на другую нижеоплачиваемую работу у данного работодателя за ним сохраняется средний заработок по прежней работе:
Статья 72.1. Перевод на другую работу. Перемещение
Читайте также
Статья 28. Перевод на иную должность гражданской службы или перемещение
Статья 28. Перевод на иную должность гражданской службы или перемещение 1. Перевод гражданского служащего на иную должность гражданской службы в случаях, установленных настоящим Федеральным законом, в том же государственном органе, либо перевод гражданского служащего
Статья 8. Отнесение земель к категориям, перевод их из одной категории в другую
Статья 8. Отнесение земель к категориям, перевод их из одной категории в другую
1. Отнесение земель к категориям, перевод их из одной категории в другую осуществляются в отношении:1) земель, находящихся в федеральной собственности, – Правительством Российской Федерации;2)
Отнесение земель к категориям, перевод их из одной категории в другую
1. Отнесение земель к категориям, перевод их из одной категории в другую осуществляются в отношении:1) земель, находящихся в федеральной собственности, – Правительством Российской Федерации;2)
Статья 72.1. Перевод на другую работу. Перемещение
Статья 72.1. Перевод на другую работу. Перемещение Перевод на другую работу – постоянное или временное изменение трудовой функции работника и (или) структурного подразделения, в котором работает работник (если структурное подразделение было указано в трудовом договоре),
Статья 72.2. Временный перевод на другую работу
Статья 72.2. Временный перевод на другую работу По соглашению сторон, заключаемому в письменной форме, работник может быть временно переведен на другую работу у того же работодателя на срок до одного года, а в случае, когда такой перевод осуществляется для замещения
Статья 73.
 Перевод работника на другую работу в соответствии с медицинским заключением
Перевод работника на другую работу в соответствии с медицинским заключениемСтатья 73. Перевод работника на другую работу в соответствии с медицинским заключением Работника, нуждающегося в переводе на другую работу в соответствии с медицинским заключением, выданным в порядке, установленном федеральными законами и иными нормативными правовыми
Статья 254. Перевод на другую работу беременных женщин и женщин, имеющих детей в возрасте до полутора лет
Статья 254. Перевод на другую работу беременных женщин и женщин, имеющих детей в возрасте до полутора лет Беременным женщинам в соответствии с медицинским заключением и по их заявлению снижаются нормы выработки, нормы обслуживания либо эти женщины переводятся на другую
Статья 72.2. Временный перевод на другую работу
Статья 72. 2. Временный перевод на другую работу
По соглашению сторон, заключаемому в письменной форме, работник может быть временно переведен на другую работу у того же работодателя на срок до одного года, а в случае, когда такой перевод осуществляется для замещения
2. Временный перевод на другую работу
По соглашению сторон, заключаемому в письменной форме, работник может быть временно переведен на другую работу у того же работодателя на срок до одного года, а в случае, когда такой перевод осуществляется для замещения
Статья 73. Перевод работника на другую работу в соответствии с медицинским заключением
Статья 73. Перевод работника на другую работу в соответствии с медицинским заключением Работника, нуждающегося в переводе на другую работу в соответствии с медицинским заключением, выданным в порядке, установленном федеральными законами и иными нормативными правовыми
Статья 169. Возмещение расходов при переезде на работу в другую местность
Статья 169. Возмещение расходов при переезде на работу в другую местность При переезде работника по предварительной договоренности с работодателем на работу в другую местность работодатель обязан возместить работнику:расходы по переезду работника, членов его семьи и
Статья 254.
 Перевод на другую работу беременных женщин и женщин, имеющих детей в возрасте до полутора лет
Перевод на другую работу беременных женщин и женщин, имеющих детей в возрасте до полутора летСтатья 254. Перевод на другую работу беременных женщин и женщин, имеющих детей в возрасте до полутора лет Беременным женщинам в соответствии с медицинским заключением и по их заявлению снижаются нормы выработки, нормы обслуживания либо эти женщины переводятся на другую
Статья 8. Отнесение земель к категориям, перевод их из одной категории в другую
Статья 8. Отнесение земель к категориям, перевод их из одной категории в другую 1. Перевод земель из одной категории в другую осуществляется в отношении:1) земель, находящихся в федеральной собственности, – Правительством Российской Федерации;2) земель, находящихся в
3 Гарантии при переводе на другую работу
3 Гарантии при переводе на другую работу Устраиваясь на работу на определенное предприятие и по определенной специальности, заключая трудовой договор с работодателем, гражданин желает выполнять свои трудовые обязанности четко в соответствии с трудовым договором и в
Статья 41.
 5. Перевод прокурорского работника на службу в другую местность
5. Перевод прокурорского работника на службу в другую местностьСтатья 41.5. Перевод прокурорского работника на службу в другую местность 1. Перевод прокурорского работника в интересах службы в другую местность допускается только с его согласия, а при переводе в местности с тяжелыми и неблагоприятными климатическими условиями –
Статья 8 Отнесение земель к категориям, перевод их из одной категории в другую
Статья 8 Отнесение земель к категориям, перевод их из одной категории в другую 1. Категория земель определяется их целевым назначением. В ст.7 Кодекса, регулирующей состав земель в Российской Федерации, категории земель перечислены исчерпывающим образом (см. указанную
ПЕРЕВОД НА ДРУГУЮ РАБОТУ И ПЕРЕМЕЩЕНИЕ
ПЕРЕВОД НА ДРУГУЮ РАБОТУ И ПЕРЕМЕЩЕНИЕ
Перевод на другую постоянную работу – изменение трудовой функции работника по специальности, квалификации или должности или изменение существенных условий трудового договора. Перевод на другую постоянную работу правомерен
Перевод на другую постоянную работу правомерен
Перевод на другую работу
Перевод на другую работу Перевод на другую работу — постоянное или временное изменение трудовой функции работника и (или) структурного подразделения, в котором работает работник (если структурное подразделение было указано в трудовом договоре), при продолжении работы у
Перевод работника с временной на постоянную работу
Сотрудники учреждений могут получить статус временных по ряду причин. Одной из них является замещение другого специалиста на должности, если он ушел в административный отпуск, декрет и т.п. Но прежний работник может впоследствии уволиться. В этом случае непременно встанет вопрос, как принятого ранее перевести с временной должности на постоянную работу. Процедура не подразумевает сложную схему действий. Не обязательно составлять заявление с просьбой уволить, а следом за ним — с требованием принять вновь.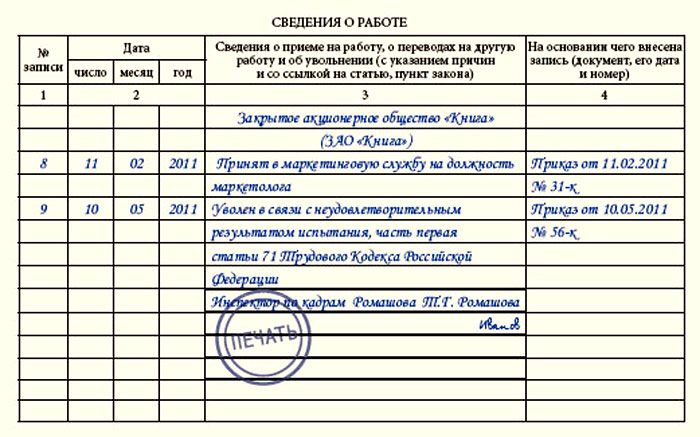 Однако есть некоторые нюансы, которые стоит учесть. Они связаны с оформлением бумаг.
Однако есть некоторые нюансы, которые стоит учесть. Они связаны с оформлением бумаг.
Перевод с временной должности на постоянную по Трудовому кодексу РФ
Статья 58 ТК РФ предполагает наличие определенных требований. Срочный трудовой договор может потерять силу, если ни сотрудник, ни работодатель ранее не запросили расторжения документа из-за его просроченной даты. При этом специалист как и раньше осуществляет свои функции после того, как срок действия договора истек.
ВниманиеПосле того, как срочный трудовой договор потерял силу, он автоматически переходит в статус заключенного на неопределенное время. Потребуется дополнительное соглашение. В нем будет указано, что договор бессрочен, а работа меняет характер с временной на постоянную.
Необходимые документы
Перечень документов, необходимых для оформления статуса постоянной работы внутри организации:
- Заявление от специалиста с просьбой оформить его на постоянную должность. Его следует написать до того, как закончится действие временного договора.
 Документ оформляется на имя первого лица компании.
Документ оформляется на имя первого лица компании. - Приказ о переводе работника с временной на постоянную работу, оформленный на основании заявления. В нем указываются данные:
-вид и причины переоформления;
-инициалы специалиста;
-прежнее и новое места занятости;
-номер, дата подписания и окончания заключенного прежде трудового документа.
- Новый договор. В нем должны быть отражены должность, зарплата, права и обязательства. Составляется в двух экземплярах. Подписывается обеими сторонами, закрепляется печатью предприятия.
- Должностная инструкция. Также потребуется отметка в трудовой книге с указанием должности, даты и номера приказа.
- Приказ о том, что изменилось штатное расписание и отпускной график работника.
Есть альтернативный способ оформления — расторгнуть временный договор. Но в этом случае прерывается стаж. Потребуются новые приказ, карточка, дело. Эта процедура — вынужденная мера. К ней прибегают лишь тогда, когда до истечения временного документа не были подготовлены нужные бумаги для переоформления на постоянную работу.
Все документы требуют подписей обеих сторон и заверяются печатью организации.
Приказ о переводе сотрудника на постоянную работу
Приказ на перевод работника на постоянную работу имеет унифицированную форму № Т-5. Бланк с учетом согласия специалиста, данного в письменной форме, заполняет сотрудник отдела кадров.
Пошаговая инструкция перевода
Специфика процедуры перевода работника на постоянную работу состоит в том, что она может осуществляться и внутри организации и с переходом к другому работодателю. Для внутреннего перевода достаточно приказа и записи в трудовой книжке. Для внешнего потребуется уволиться у одного работодателя и подать заявление о приеме у другого.
Пошаговый инструктаж.
- При внешнем переоформлении новый работодатель составляет письменное заявление на ФИО руководителя предыдущего учреждения, где задействован сотрудник. В приглашении указываются инициалы специалиста, его должность, а также дата планируемого поступления в новую организацию.
 Письму присваивается номер и дата, оно заверяется печатью учреждения и подписывается директором.
Письму присваивается номер и дата, оно заверяется печатью учреждения и подписывается директором. - Нынешний руководитель составляет письмо будущему начальнику. Далее следует ответ-согласие нового руководителя, заверенное подписью и печатью.
- Уведомление о внешнем переводе на постоянную работу составляется минимум за 8 недель до совершения процедуры. Потребуется согласие работника в письменном виде. В нем он должен будет указать, что знаком с текстом уведомления.
- Приказ об увольнении-переводе составляется со ссылкой на Статью 77 ТК РФ. Документ заверяется печатью и подписью руководителя. Кроме того, в нем расписывается и сотрудник.
- Завершается часть процедуры записью в трудовой об увольнении и переходе в иное учреждение. После этого уволенный получает деньги под расчет и его личная карточка закрывается.
- Специалист, получивший книжку, составляет заявление с требованиями принять его на постоянное трудоустройство, с ним заключают договор, не предполагающий испытательного срока.
 Также формируется приказной документ о приеме на должность посредством перевода из другого учреждения. Оформляется новая личная карточка.
Также формируется приказной документ о приеме на должность посредством перевода из другого учреждения. Оформляется новая личная карточка. - При внутреннем переоформлении специалиста письменно ставят в известность о процедуре перевода работника с временной на постоянную работу за два месяца до начала составления. Сотрудник заверяет согласие подписью с датой или заявлением.
- Заключается допсоглашение к договору с учетом изменившихся обязанностей. На основании соглашения создается приказ. Оговаривается должность, инициалы, подразделение перевода, сумма зарплаты.
- В трудовой книжке прописываются соответствующие данные.
Перевод работника с постоянной работы на временную
Устройство временного сотрудника происходит со ссылкой на Статью 59 ТК РФ. Согласно ее требованиям составляется срочный договор с работником, подразумевающий определенный срок действия.
Этапы перевода.
- Оформляемый составляет заявительное письмо с присвоенным порядковым номером на имя руководящего персонала.

- Снимаются копии документов будущего временного работника — паспортные данные, СНИЛС, ИНН, диплом. Возможно, потребуются водительские права и медицинская книжка.
- Оформляется приказ о приеме. В строке «условия» прописывается «временно» с обозначением дат. Подписывается обеими сторонами.
- Формируется срочный трудовой документ, где прописываются права, обязанности и характер занятости. Если предполагается временное оформление на место основного специалиста, то указываются инициалы основного человека. Прописываются порядок оплаты, часы работы. В определенных случаях срочный договор требует дополнительных соглашений. Обычно речь идет о ситуациях, когда основной персонал продлевает отпуск по разным причинам.
- Комплектуется личное дело временного работника, создается личная карточка.
Нюансы
Нюансы переоформления временного специалиста на постоянную работу важны для тех, кто желает свести к минимуму количество ошибок. Нужно знать точные формулировки терминов ТК РФ, а также процесс составления документов, количество требуемых образцов и другую информацию.
- Перевод — назначение на определенную должность, требующее согласие от сотрудника.
- Соглашение о переоформлении подразумевает основные моменты процедуры, формируется в двух экземплярах, подписывается и сотрудником, и руководителем.
- Срок перехода — временной отрезок, в течение которого происходит данная процедура. Оговаривается индивидуально с сотрудником.
- Трудовой договор отражает данные о правах, ответственности, размере оклада.
Псевдоуридинилирование кодирующих последовательностей мРНК изменяет трансляцию
Значимость
Посттранскрипционная модификация информационных РНК (мРНК) представляет собой новый рубеж в регуляции генов. Понимание биологических последствий одной из наиболее распространенных модификаций мРНК, псевдоуридина, в клетках осложняется субстехиометрическим наличием модификаций мРНК и трудностью отделения влияния на трансляцию от стабильности мРНК. Здесь мы использовали биохимические и структурные исследования in vitro вместе с клеточными анализами, чтобы продемонстрировать, что псевдоуридин препятствует удлинению трансляции и увеличивает частоту аминокислотных замен.Наша работа поддерживает идею о том, что модификации мРНК могут модулировать трансляционную способность мРНК, и предоставляет доказательства того, что псевдоуридин может изменять отбор тРНК рибосомой. Это исследование представляет собой биохимическую основу для лучшего понимания последствий модификаций в кодирующих областях мРНК.
Здесь мы использовали биохимические и структурные исследования in vitro вместе с клеточными анализами, чтобы продемонстрировать, что псевдоуридин препятствует удлинению трансляции и увеличивает частоту аминокислотных замен.Наша работа поддерживает идею о том, что модификации мРНК могут модулировать трансляционную способность мРНК, и предоставляет доказательства того, что псевдоуридин может изменять отбор тРНК рибосомой. Это исследование представляет собой биохимическую основу для лучшего понимания последствий модификаций в кодирующих областях мРНК.
Abstract
Уже давно установлено, что химические модификации РНК являются ключевыми модуляторами структуры и функции небелковых РНК в клетках. Растет понимание того, что последовательности информационной РНК (мРНК), ответственные за управление синтезом белка, также могут быть модифицированы посттранскрипционно.Ферментативное включение модификаций мРНК имеет множество потенциальных результатов, включая изменение стабильности мРНК, рекрутирование белков и трансляцию. Мы проверили, как одна из наиболее распространенных модификаций, присутствующих в кодирующих областях мРНК, псевдоуридин (), влияет на синтез белка с использованием полностью реконструированной бактериальной системы трансляции и человеческих клеток. Наша работа показывает, что замена одного уридинового нуклеотида на в кодоне мРНК препятствует добавлению аминокислоты и активации EF-Tu GTPase. Кристаллическая структура рибосомы Thermus thermophilus 70S с тРНК Phe , связанной с кодоном ΨUU в сайте A, подтверждает эти выводы.Мы также обнаружили, что присутствие может способствовать синтезу нескольких пептидных продуктов на низком уровне из одной последовательности мРНК в восстановленной системе трансляции, а также в клетках человека, и увеличивает скорость реакции близкородственной Val-тРНК Val . на кодоне ΨUU. Подавляющее большинство фрагментов в мРНК обнаруживаются в кодирующих областях, и наше исследование предполагает, что одним из последствий столкновения с рибосомами Ψ может быть небольшое изменение как скорости трансляции, так и декодирования мРНК.
Мы проверили, как одна из наиболее распространенных модификаций, присутствующих в кодирующих областях мРНК, псевдоуридин (), влияет на синтез белка с использованием полностью реконструированной бактериальной системы трансляции и человеческих клеток. Наша работа показывает, что замена одного уридинового нуклеотида на в кодоне мРНК препятствует добавлению аминокислоты и активации EF-Tu GTPase. Кристаллическая структура рибосомы Thermus thermophilus 70S с тРНК Phe , связанной с кодоном ΨUU в сайте A, подтверждает эти выводы.Мы также обнаружили, что присутствие может способствовать синтезу нескольких пептидных продуктов на низком уровне из одной последовательности мРНК в восстановленной системе трансляции, а также в клетках человека, и увеличивает скорость реакции близкородственной Val-тРНК Val . на кодоне ΨUU. Подавляющее большинство фрагментов в мРНК обнаруживаются в кодирующих областях, и наше исследование предполагает, что одним из последствий столкновения с рибосомами Ψ может быть небольшое изменение как скорости трансляции, так и декодирования мРНК.
Нуклеозиды в информационных РНК (мРНК) можно ферментативно модифицировать посттранскрипционно (1, 2), чтобы расширить химические и топологические свойства этих важных биомолекул.Полнотранскриптомное картирование индивидуальных модификаций выявило наличие модификаций как в нетранслируемых, так и в кодирующих белки областях мРНК (2, 3). Локализация модификаций по всей мРНК предполагает, что модификации потенциально могут изменять продукцию белка с помощью множества механизмов, включая влияние на взаимодействия транслирующего рибосомного комплекса с мРНК, структуру мРНК и стабильность мРНК. Среди модификаций мРНК, идентифицированных на сегодняшний день, наиболее распространены N6-метиладенонин (m 6 A) и псевдоуридин () (2, 4).m 6 A модификации, по оценкам, происходят в половине мРНК человека, а клетки содержат набор белков, которые, как сообщается, записывают, читают и стирают модификацию (5, 6).
Ψ было сопоставлено с сотнями последовательностей мРНК (7⇓ – 9), а исследования масс-спектрометрии показывают, что отношение Ψ / U в линиях клеток человека сравнимо с таковым для m. 6 A / A (∼0,3% для Ψ / U vs. ∼0.5% m 6 A / A) (10, 11). Хотя частота на большинстве нанесенных на карту участков не установлена, оценки-частоты, основанные на экспериментах с Ψ-seq, и прямое измерение занятости в дискретном узле (в EEF1A1) показывают, что может быть включена на частотах ( > 50%) сопоставимо с хорошо заселенными участками m 6 A (8, 10).Преобладание-фрагментов в мРНК находится в кодирующих областях (> 60%), и хотя было идентифицировано множество псевдоуридинилирующих ферментов, которые включают как в мРНК, так и в некодирующие РНК воспроизводимым, специфическим и индуцируемым образом (7⇓⇓– 10, 12⇓ – 14), белки, которые читают или стирают Ψ, обнаружены не были. Следовательно, рибосома обязательно встречает в клетках, и было высказано предположение, что она может служить ключевым клеточным компонентом для чтения в мРНК (2). Как, или даже если, псевдоуридинилирование мРНК способствует экспрессии генов, пока неясно.Репортерные исследования клеток человека и бактериальных лизатов приводят к противоречивым выводам относительно роли, при этом некоторые исследования предполагают, что присутствие в кодонах мРНК увеличивает продукцию белка (15), а другие сообщают о снижении синтеза белка (16, 17).
6 A / A (∼0,3% для Ψ / U vs. ∼0.5% m 6 A / A) (10, 11). Хотя частота на большинстве нанесенных на карту участков не установлена, оценки-частоты, основанные на экспериментах с Ψ-seq, и прямое измерение занятости в дискретном узле (в EEF1A1) показывают, что может быть включена на частотах ( > 50%) сопоставимо с хорошо заселенными участками m 6 A (8, 10).Преобладание-фрагментов в мРНК находится в кодирующих областях (> 60%), и хотя было идентифицировано множество псевдоуридинилирующих ферментов, которые включают как в мРНК, так и в некодирующие РНК воспроизводимым, специфическим и индуцируемым образом (7⇓⇓– 10, 12⇓ – 14), белки, которые читают или стирают Ψ, обнаружены не были. Следовательно, рибосома обязательно встречает в клетках, и было высказано предположение, что она может служить ключевым клеточным компонентом для чтения в мРНК (2). Как, или даже если, псевдоуридинилирование мРНК способствует экспрессии генов, пока неясно.Репортерные исследования клеток человека и бактериальных лизатов приводят к противоречивым выводам относительно роли, при этом некоторые исследования предполагают, что присутствие в кодонах мРНК увеличивает продукцию белка (15), а другие сообщают о снижении синтеза белка (16, 17). ). Наиболее четкие доказательства биологической роли в мРНК получены из исследований на паразите Toxoplasma gondii , где Ψ увеличивает стабильность мРНК и способствует дифференцировке паразитов (12, 13). Независимо от того, выявят ли дальнейшие исследования значительную роль в регуляции генов, рибосома точно транслирует-содержащие кодоны в клетках, и важно установить возможные результаты этих событий.
). Наиболее четкие доказательства биологической роли в мРНК получены из исследований на паразите Toxoplasma gondii , где Ψ увеличивает стабильность мРНК и способствует дифференцировке паразитов (12, 13). Независимо от того, выявят ли дальнейшие исследования значительную роль в регуляции генов, рибосома точно транслирует-содержащие кодоны в клетках, и важно установить возможные результаты этих событий.
Поскольку может изменять фундаментальные свойства РНК, включая их вторичные структуры и способность к спариванию оснований (18⇓ – 20), было предложено, что одним из последствий может быть содействие включению нескольких аминокислот в одну кодон (2, 8). Действительно,-содержащие стоп-кодоны, как было обнаружено, управляют бессмысленным подавлением терминации трансляции (14, 21), хотя влияние Ψ на стоп-кодоны остается нерешенным вопросом (22). До сих пор не сообщалось о дифференциальном декодировании Ψ-содержащих смысловых кодонов (16, 17).Установление того, может ли Ψ изменить выбор тРНК на рибосоме, является своевременным вопросом, учитывая, что широкий спектр модифицированных нуклеозидов (β, N1-метил-β, 2-тиуридин, 5-метилцитозин) обычно вставляется в синтетические мРНК с высокой скоростью. стехиометрические соотношения для терапевтического применения (15).
стехиометрические соотношения для терапевтического применения (15).
Выявление последствий модификации мРНК в клетках затруднено, потому что ферменты, которые включают в мРНК, также катализируют Ψ добавление к некодирующим видам РНК. Кроме того, влияние стабильности мРНК и белка на выход белка может быть трудным для деконволюции из-за воздействия на трансляцию в клетках.Здесь мы непосредственно исследуем механистические эффекты псевдоуридинилирования мРНК на трансляцию, используя энзимологию in vitro, а также рентгеновскую кристаллографию, и поддерживаем наши выводы in vitro с помощью клеточных подходов. Наши результаты демонстрируют, что вставка одного нарушает функцию рибосомы и способствует низкоуровневому синтезу нескольких пептидных продуктов из одной последовательности мРНК в зависимости от контекста. Эти исследования обеспечивают основу для понимания эффектов β-модификации на трансляцию мРНК в клетках.
Результаты
Ψ Снижает константы скорости для удлинения трансляции и активации EF-Tu GTPase.

Мы оценили, влияет ли Ψ на трансляцию, выполнив кинетические анализы с хорошо зарекомендовавшей себя восстановленной системой трансляции Escherichia coli (23, 24). В наших анализах 70 нМ рибосомных комплексов E. coli 70S, содержащих 35 S-меченный формилметионин-тРНК fMet в P-сайте и кодон UUU в A-сайте, реагировали с 0.5–5 мкМ Phe-тРНК Phe • EF-Tu • GTP (тройной комплекс) при 37 ° C и продукты визуализировали с помощью электрофоретической ТСХ ( SI Приложение , рис. S1). Мы измерили скорость добавления фенилаланина (Phe) к кодонам UUU, ΨUU, UΨU и UUΨ, поскольку константа скорости образования дипептида на кодоне UUU хорошо известна (23), а Ψ регулярно обнаруживается в кодонах UUU в клетках (7, 10). ) (Рис. 1; подробности оценки качества олигонуклеотидов с помощью UHPLC-MS / MS в SI Приложение ). Phe надежно встраивался в немодифицированные мРНК с конечной точкой реакции и константами скорости, аналогичными ранее описанным (23, 25) (рис.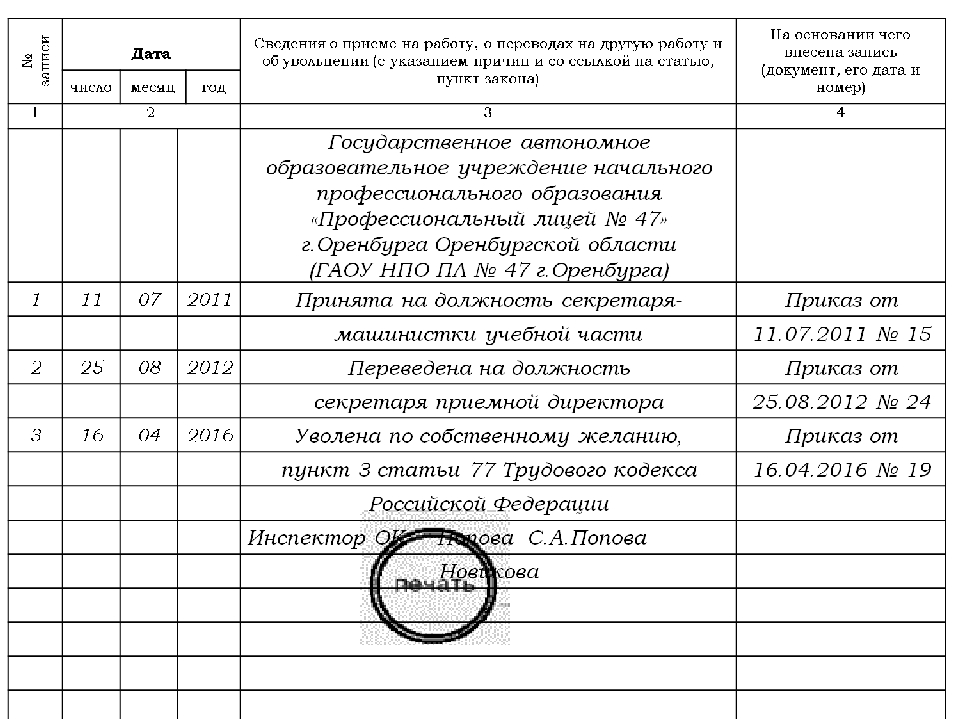 1 и SI Приложение , Таблица S1). f Образование дипептида Met-Phe, катализируемое рибосомами на Ψ-содержащих мРНК, также было завершено ( SI Приложение , таблица S1), а k max для включения Phe при концентрациях Phe-tRNA Phe ниже 5 мкМ. (15,7 ± 0,9 с −1 ) не был затронут (рис. 1, SI, приложение , таблица S1). Однако константа скорости образования дипептида f Met-Phe была умеренно снижена в 2 раза в условиях реакции с субнасыщающими концентрациями Phe-тРНК Phe (рис.1 C и SI Приложение , Таблица S1). Мы аппроксимировали K 1/2 для включения Phe в UUU и ΨUU и обнаружили, что значение увеличивается в 2 раза на UU. В соответствии с этим, мы обнаружили, что продукция полноразмерного пептида люциферазы в восстановленной системе трансляции in vitro (NEB PURExpress) в 3 раза медленнее на мРНК репортера люциферазы с каждым U, замененным на ( SI Приложение , рис.
1 и SI Приложение , Таблица S1). f Образование дипептида Met-Phe, катализируемое рибосомами на Ψ-содержащих мРНК, также было завершено ( SI Приложение , таблица S1), а k max для включения Phe при концентрациях Phe-tRNA Phe ниже 5 мкМ. (15,7 ± 0,9 с −1 ) не был затронут (рис. 1, SI, приложение , таблица S1). Однако константа скорости образования дипептида f Met-Phe была умеренно снижена в 2 раза в условиях реакции с субнасыщающими концентрациями Phe-тРНК Phe (рис.1 C и SI Приложение , Таблица S1). Мы аппроксимировали K 1/2 для включения Phe в UUU и ΨUU и обнаружили, что значение увеличивается в 2 раза на UU. В соответствии с этим, мы обнаружили, что продукция полноразмерного пептида люциферазы в восстановленной системе трансляции in vitro (NEB PURExpress) в 3 раза медленнее на мРНК репортера люциферазы с каждым U, замененным на ( SI Приложение , рис. S2).
S2).
Ψ изменяет включение аминокислоты в рибосому.( A ) Кодирующие последовательности для Ψ-содержащих конструкций мРНК. ( B и C ) Временные графики, отображающие образование пептида f Met-Phe на немодифицированном и модифицированном кодоне UUU [UUU (черные кружки), ΨUU (синие квадраты), UΨU (зеленые ромбы), UUΨ ( красные треугольники)]. Курсы времени собирали в условиях однократного оборота (70–100 нМ 70S рибосомные инициирующие комплексы с либо [ B ], близкими к насыщению [1 мкМ], либо [ C ] высокими [5 мкМ] уровнями Phe-тРНК . Phe ).
Пониженные наблюдаемые константы скорости включения аминокислот в псевдоуридинилированные кодоны при суб- и близких к насыщению концентрациях Phe-тРНК Phe могут отражать изменения констант скорости для одной или нескольких из нескольких предшествующих кинетических стадий (23) ( SI Приложение , рис. S3). Чтобы получить более полное представление о том, на какие стадии влияет, мы измерили константы скорости гидролиза GTP с помощью EF-Tu после связывания тройного комплекса aa-tRNA • EF-Tu • GTP с сайтом A. В этих анализах 1,8 мкМ 3 H- f Met-меченные комплексы смешивали со 100 нМ α- 32 P-GTP-меченого тройного комплекса. Наблюдаемая константа скорости гидролиза GTP на немодифицированном кодоне UUU ( k GTP = 78 ± 10 с -1 ) соответствовала ранее опубликованным значениям (23), в то время как константа скорости была меньше на кодоне ΨUU ( k GTP = 42 ± 6 с −1 ) (Рис.2 A и B , SI Приложение , Таблица S1).
В этих анализах 1,8 мкМ 3 H- f Met-меченные комплексы смешивали со 100 нМ α- 32 P-GTP-меченого тройного комплекса. Наблюдаемая константа скорости гидролиза GTP на немодифицированном кодоне UUU ( k GTP = 78 ± 10 с -1 ) соответствовала ранее опубликованным значениям (23), в то время как константа скорости была меньше на кодоне ΨUU ( k GTP = 42 ± 6 с −1 ) (Рис.2 A и B , SI Приложение , Таблица S1).
Ψ изменяет гидролиз GTP во время связывания тройного комплекса с рибосомой. ( A ) Временные графики, отображающие образование GDP при смешивании 1,6 мкМ 3 H-fMet-меченных комплексов со 100 нМ γ- 32 P-GTP-меченого тройного комплекса, образованного с Phe-tRNA Phe и безнуклеотидный EF-Tu. Одноэкспоненциальные кривые были подогнаны к данным, собранным в 3 независимых экспериментах. ( B ) Наблюдаемые константы скорости для данных, соответствующих A . Планки погрешностей — это SE подобранного значения k obs . ( C и D ) 2Fo-Fc карты Фурье электронной разности (синяя сетка) для связанного с рибосомами сайта A (зеленый) и сайта P (темно-синий), взаимодействующих с немодифицированными ( C ) или Ψ-содержащая мРНК ( D ). В C и карта, и модель взяты из записи PDB 4Y4P. Направление обзора для обеих панелей указано на вставке справа вверху в C .Уточненные модели мРНК (пурпурный) и тРНК (зеленый) отображаются с соответствующими электронными плотностями, очерченными на 1,2σ. Увеличенные изображения CCA-концов тРНК A-сайта показаны нижними правыми вставками на каждой из панелей. Электронная плотность, соответствующая CCA-концу тРНК, взаимодействующей с-содержащей мРНК, намного слабее по сравнению с CCA-концом тРНК, взаимодействующей с немодифицированной мРНК, в то время как электронная плотность, соответствующая телам A-сайта тРНК сопоставимы между двумя комплексами.
Планки погрешностей — это SE подобранного значения k obs . ( C и D ) 2Fo-Fc карты Фурье электронной разности (синяя сетка) для связанного с рибосомами сайта A (зеленый) и сайта P (темно-синий), взаимодействующих с немодифицированными ( C ) или Ψ-содержащая мРНК ( D ). В C и карта, и модель взяты из записи PDB 4Y4P. Направление обзора для обеих панелей указано на вставке справа вверху в C .Уточненные модели мРНК (пурпурный) и тРНК (зеленый) отображаются с соответствующими электронными плотностями, очерченными на 1,2σ. Увеличенные изображения CCA-концов тРНК A-сайта показаны нижними правыми вставками на каждой из панелей. Электронная плотность, соответствующая CCA-концу тРНК, взаимодействующей с-содержащей мРНК, намного слабее по сравнению с CCA-концом тРНК, взаимодействующей с немодифицированной мРНК, в то время как электронная плотность, соответствующая телам A-сайта тРНК сопоставимы между двумя комплексами.
тРНК
Phe 3’CCA не упорядочена в кристаллической структуре комплекса бактериальных рибосом 70S с UU. Чтобы исследовать, изменяет ли присутствие в кодоне мРНК взаимодействия тРНК с рибосомой во время элонгации трансляции, мы решили кристаллическую структуру рибосомы T. thermophilus 70S в комплексе с UU-содержащей мРНК, тРНК P-сайта i Met и тРНК A-сайта Phe (на кодоне ΨUU A-сайта) с разрешением 2,95 Å (рис.2 C и D , SI Приложение , Таблица S2, PDB 6OU1). Мы сравнили эту структуру с нашей ранее опубликованной структурой того же самого 70S рибосомного комплекса, содержащего тРНК Phe из того же препарата в рибосомном сайте A, распознающем немодифицированный кодон Phe. В нашей структуре, содержащей ΨUU, мы наблюдали сильную электронную плотность, соответствующую телу и стебле-петле антикодона тРНК Phe A-сайта, взаимодействующей с кодоном мРНК ( SI Приложение , рис. S4), аналогичные предыдущим структурам, содержащим немодифицированные мРНК (26). Значение RMSD 0,612, рассчитанное для всего тела тРНК A-сайта (остатки 1–73), указывает на то, что она остается в своем нормальном положении.
S4), аналогичные предыдущим структурам, содержащим немодифицированные мРНК (26). Значение RMSD 0,612, рассчитанное для всего тела тРНК A-сайта (остатки 1–73), указывает на то, что она остается в своем нормальном положении.
Наблюдаемая электронная плотность, соответствующая CCA-концу тРНК в рибосомном сайте A, сильна и хорошо определена в большинстве ранее опубликованных структур (26). Как и ожидалось, это относится к полностью адаптированному CCA-концу тРНК Phe , взаимодействующему с немодифицированной мРНК (рис.2 С ). Однако, когда присутствует-содержащая мРНК, мы не наблюдали электронной плотности для оснований CCA-конца той же тРНК Phe A-сайта, хотя остальная часть тела тРНК была видна (рис. 2 D ). Даже после уточнения наших рентгеновских данных по сравнению с моделью 70S рибосомы, содержащей полноразмерную тРНК Phe в сайте A, плотность оснований CCA-конца не наблюдалась в ( 2Fo-Fc ). карта электронной плотности (рис. 2 D , врезка ).Эти данные указывают на гибкость CCA-конца тРНК A-сайта, взаимодействующего с кодоном ΨUU. Как следствие, CCA-конец этой тРНК неспособен образовывать канонические взаимодействия в сайте A пептидилтрансферазного центра (PTC) на большой субъединице рибосомы, которая обычно включает образование пары оснований Уотсона-Крика между C75 нуклеотид тРНК A-сайта и G2553 23S рРНК. Поскольку основным отличием комплекса 70S, кристаллизованного в этом исследовании, является замена уридина на в каноническом кодоне Phe, отсутствие CCA-конца в электронной плотности, вероятно, объясняется изменениями в декодировании кодона, которые происходят в противоположный конец молекулы тРНК в декодирующем центре и, по-видимому, распространяется до ПТК (рис.2 C и D ). Смещение CCA-конца тРНК A-сайта наблюдалось во многих структурах рибосомы, связанной с антибиотиками [например, Мадумицин II (27) или гигромицин A (28)]. В этих связанных с антибиотиком рибосомных структурах наблюдаемые конформационные изменения в CCA-конце являются результатом стерического вмешательства между CCA-концом и лекарством, что препятствует правильному позиционированию акцепторного стержня тРНК в 70S рибосомной PTC.
2 D , врезка ).Эти данные указывают на гибкость CCA-конца тРНК A-сайта, взаимодействующего с кодоном ΨUU. Как следствие, CCA-конец этой тРНК неспособен образовывать канонические взаимодействия в сайте A пептидилтрансферазного центра (PTC) на большой субъединице рибосомы, которая обычно включает образование пары оснований Уотсона-Крика между C75 нуклеотид тРНК A-сайта и G2553 23S рРНК. Поскольку основным отличием комплекса 70S, кристаллизованного в этом исследовании, является замена уридина на в каноническом кодоне Phe, отсутствие CCA-конца в электронной плотности, вероятно, объясняется изменениями в декодировании кодона, которые происходят в противоположный конец молекулы тРНК в декодирующем центре и, по-видимому, распространяется до ПТК (рис.2 C и D ). Смещение CCA-конца тРНК A-сайта наблюдалось во многих структурах рибосомы, связанной с антибиотиками [например, Мадумицин II (27) или гигромицин A (28)]. В этих связанных с антибиотиком рибосомных структурах наблюдаемые конформационные изменения в CCA-конце являются результатом стерического вмешательства между CCA-концом и лекарством, что препятствует правильному позиционированию акцепторного стержня тРНК в 70S рибосомной PTC.
Ψ Способствует замене аминокислот в восстановленном
E.coli Система перевода. Ψ может изменять взаимодействия пар оснований между антикодонами тРНК и мРНК. Это повысило вероятность того, что может с некоторой частотой заставлять рибосому принимать аминоацил-тРНК (аа-тРНК), которая не может быть родственной по U-содержащему кодону. Чтобы проверить эту возможность, мы подготовили пулы общей аа-тРНК, заряжая всего тРНК E. coli с использованием экстракта S100. Затем мы представили 70S рибосомные комплексы с разбавленной смесью аа-тРНК, связанных с EF-Tu, вместо чистой Phe-тРНК Phe .Если отбор а-тРНК не изменен, мы должны почти всегда видеть образование дипептида f Met-Phe. Как и ожидалось, 97% дипептидов, образованных на кодонах UUU, были продуктом f Met-Phe (фиг. 3 и SI, приложение , фиг. S5). Напротив, мРНК, содержащие UU или UUΨ, управляли синтезом множества продуктов (рис. 3) с разумной эффективностью; почти половина всех пептидов, продуцируемых на мРНК ΨUU, были альтернативными продуктами Met-Phe, отличными от f (фиг. 3 B и SI, приложение , S5 A ).Степень, в которой Ψ способствует замене аминокислот, по-видимому, зависит от контекста — мы обнаружили различные уровни аминокислотной замены в рибосомных комплексах, запрограммированных модифицированным стоп-кодоном (AA) в сайте A (рис. 3 C ). Важно отметить, что эти эксперименты проводились в условиях, имитирующих голодание и приводящих к снижению точности перевода. Мы не ожидаем, что близкие к родственным тРНК будут столь же эффективно конкурировать с заметными концентрациями родственных аа-тРНК.
3 B и SI, приложение , S5 A ).Степень, в которой Ψ способствует замене аминокислот, по-видимому, зависит от контекста — мы обнаружили различные уровни аминокислотной замены в рибосомных комплексах, запрограммированных модифицированным стоп-кодоном (AA) в сайте A (рис. 3 C ). Важно отметить, что эти эксперименты проводились в условиях, имитирующих голодание и приводящих к снижению точности перевода. Мы не ожидаем, что близкие к родственным тРНК будут столь же эффективно конкурировать с заметными концентрациями родственных аа-тРНК.
Ψ способствует включению альтернативных аминокислот рибосомой в предельных концентрациях аа-тРНК. ( A ) Электрофоретическая ТСХ, отображающая продукты трансляции смеси мРНК, содержащих один рандомизированный кодон (NNN), и немодифицированных и содержащих сообщений UUU в присутствии тРНК (ноль), тРНК Phe-тРНК Phe ( phe TC) и общая aa-тРНК (общая TC). Трансляция пула мРНК NNN со случайными кодонами в сайте A демонстрирует присутствие нескольких видов аа-тРНК аа в препарате тотальной тРНК. ( B ) Процент аминокислотных замещенных дипептидов относительно правильного продукта fMet-Phe на немодифицированных и модифицированных кодонах UUU (например,%, не образующий ожидаемый пептид MF). ( C ) Процент рибосом, которые реагируют с 2 мкМ Lys-тРНК Lys тройным комплексом на стоп-кодонах UAA и ΨAA с образованием пептида MK через 10 мин. Почти родственная Lys-тРНК Lys реагирует с образованием вдвое большего количества пептида на ΨAA, чем на UAA. Все данные, отображаемые на графиках, отражают средние значения и SE по крайней мере 3 экспериментов.
( B ) Процент аминокислотных замещенных дипептидов относительно правильного продукта fMet-Phe на немодифицированных и модифицированных кодонах UUU (например,%, не образующий ожидаемый пептид MF). ( C ) Процент рибосом, которые реагируют с 2 мкМ Lys-тРНК Lys тройным комплексом на стоп-кодонах UAA и ΨAA с образованием пептида MK через 10 мин. Почти родственная Lys-тРНК Lys реагирует с образованием вдвое большего количества пептида на ΨAA, чем на UAA. Все данные, отображаемые на графиках, отражают средние значения и SE по крайней мере 3 экспериментов.
Чтобы определить, какие аминокислоты включены в-содержащие кодоны UUU, мы провели реакции трансляции с общей тРНК, заряженной по одной либо валином (Val), изолейцином (Ile), лейцином (Leu) или серином (Ser ) (Рис.4 и SI Приложение , S5). Эти аминокислоты были выбраны для исследования на основе миграции замещенных аминокислотами пептидов в экспериментах с электрофоретической ТСХ (фиг. 3 A ) и их антикодонов тРНК. Val и Leu были включены в кодоны UU и UUΨ, Ile был включен только в UU, а Ser не был включен выше фона (рис.4 B и SI Приложение , S5 B ). Наши данные согласуются с известными возможными взаимодействиями пары оснований (29⇓ – 31) и дополнительно предполагают, что пара оснований Ψ: U может удовлетворять требованиям для декодирования в первой позиции ( SI Приложение , Таблица S3) . Это удивительная степень гибкости для сайта декодирования, который, как правило, строго контролирует взаимодействие кодон-антикодон.
3 A ) и их антикодонов тРНК. Val и Leu были включены в кодоны UU и UUΨ, Ile был включен только в UU, а Ser не был включен выше фона (рис.4 B и SI Приложение , S5 B ). Наши данные согласуются с известными возможными взаимодействиями пары оснований (29⇓ – 31) и дополнительно предполагают, что пара оснований Ψ: U может удовлетворять требованиям для декодирования в первой позиции ( SI Приложение , Таблица S3) . Это удивительная степень гибкости для сайта декодирования, который, как правило, строго контролирует взаимодействие кодон-антикодон.
Аминокислоты из близкородственных и непознанных тРНК включены в Ψ-содержащие кодоны.( A ) Электрофоретическая ТСХ, отображающая продукты трансляции NNN и-содержащих сообщений в присутствии общей аа-тРНК (общей), общей тРНК, аминоацилированной валином (val TC), общей тРНК, аминоацилированной изолейцином (ile TC), и общая аа-тРНК, аминоацилированная лейцином (leu TC). ( B ) Процент продуктов MV / ML / MI, образованных на UUU и-содержащих кодонах, относительно NNN. Представленные на графике значения представляют собой среднее значение 4 экспериментов, а полосы ошибок отражают стандартную погрешность. ( C ) Сводка аминокислотных замен, наблюдаемых с помощью масс-спектрометрии в люциферазном пептиде, включенном в-содержащие мРНК, транслируемые в клетках 293H.
Представленные на графике значения представляют собой среднее значение 4 экспериментов, а полосы ошибок отражают стандартную погрешность. ( C ) Сводка аминокислотных замен, наблюдаемых с помощью масс-спектрометрии в люциферазном пептиде, включенном в-содержащие мРНК, транслируемые в клетках 293H.
Чтобы количественно определить, снижает ли способность рибосом E. coli различать родственные и близкие / непознанные аа-тРНК, мы провели кинетические анализы с почти родственной Val-тРНК Val . В присутствии EF- Ц и смесь регенерации энергии (32).Мы наблюдали всплеск, за которым следует длинная линейная фаза ( SI Приложение , рис. S7). И всплеск, и константа скорости были в 2 раза больше на ΨUU (рис. 5 A и SI, приложение , S7). Эти различия могут отражать изменения на любом этапе до переноса пептидила, включая перенос пептидила, но — с учетом наших экспериментальных условий ([Mg (II)] свободный = 10 мМ) — скорее всего, сообщают об относительных скоростях аккомодации и отторжения Val-тРНК. Val на UUU и ΨUU, аналогично тому, что ранее наблюдалось для включения Leu-тРНК Leu в кодон UUU (33).Эти данные согласуются с двукратным увеличением, которое мы наблюдаем во включении Val на ΨUU, прореагировавшем с Val-тРНК Val , заряженной из смеси тотальной тРНК (фиг. 4 B ).
Val на UUU и ΨUU, аналогично тому, что ранее наблюдалось для включения Leu-тРНК Leu в кодон UUU (33).Эти данные согласуются с двукратным увеличением, которое мы наблюдаем во включении Val на ΨUU, прореагировавшем с Val-тРНК Val , заряженной из смеси тотальной тРНК (фиг. 4 B ).
Ψ изменяет способ считывания кодонов. ( A ) k app значения для f Met-Val и образование на кодонах UUU и ΨUU в присутствии 10 нМ EF-Tu и 10 мкМ Val-тРНК Val . ( B ) Положение кодонов и пептидил-тРНК в очищенных комплексах удлинения рибосом перед добавлением анализа для наблюдения за несоответствием Р-сайтов RF2 и RF2 / RF3.( C ) Константы скорости преждевременного гидролиза f Met-Lys из fMet-Lys-тРНК lys , связанного с UAA или ΨAA в P-сайте, катализируемого RF2 (белый) и RF2 / RF3 (серый). ( D и E ) f Высвобождение Met на стоп-кодонах UAA (квадраты), ΨAA (кружки), катализируемое 500 нМ RF1 ( D ) или RF2 ( E ).
Ψ Повышает уровень аминокислотной замены в эмбриональных клетках почек человека.
Затем мы исследовали влияние на аминокислотную замену во время трансляции в эукариотических клетках.МРНК люциферазы транскрибировали in vitro с помощью уридина или β и трансфицировали в клетки 293H ( SI, приложение , фиг. S8). Белок люциферазы полной длины очищали ( SI, приложение , рис. S9) и анализировали масс-спектрометрией с акцентом на специфический пептид люциферазы с благоприятными ионизационными характеристиками. Аминокислотные замены в этом пептиде, которые составили ∼1%, наблюдались только в пептидах, генерируемых из-содержащих мРНК (рис. 4 C и SI, приложение , рис.S10 и таблицы S4 и S5). Мы также расширили наш анализ на весь набор данных по люциферазе. Белок люциферазы, транслируемый с-содержащих мРНК, обладал значительно более высокой скоростью аминокислотных замен (всего ~ 1,5%, интегрированной по всем-содержащим кодонам) по сравнению с белком, синтезированным из уридин-содержащих мРНК (замены в сумме <0,05% наблюдались только на два кодона Val) ( SI, приложение , таблица S6). События неправильного кодирования, которые мы наблюдали в наших образцах, содержащих немодифицированный уридин (замены Val), вероятно, являются относительно распространенными заменами, поскольку они также были замечены более сложными подходами масс-спектрометрии, исследующими немодифицированные последовательности EF-Tu (34).Эти наблюдения согласуются с ожидаемыми уровнями аминокислотных замен, которые мы могли бы оценить из наших кинетических исследований in vitro с родственным Phe-тРНК Phe и почти родственным Val-тРНК Val , которые предполагают, что в условиях, когда все тРНК являются одинаково хорошо заряженный и доступный, ожидаемый общий уровень аминокислотной замены в кодонах ΨUU должен составлять ~ 1% ( SI, приложение , рис. S7).
События неправильного кодирования, которые мы наблюдали в наших образцах, содержащих немодифицированный уридин (замены Val), вероятно, являются относительно распространенными заменами, поскольку они также были замечены более сложными подходами масс-спектрометрии, исследующими немодифицированные последовательности EF-Tu (34).Эти наблюдения согласуются с ожидаемыми уровнями аминокислотных замен, которые мы могли бы оценить из наших кинетических исследований in vitro с родственным Phe-тРНК Phe и почти родственным Val-тРНК Val , которые предполагают, что в условиях, когда все тРНК являются одинаково хорошо заряженный и доступный, ожидаемый общий уровень аминокислотной замены в кодонах ΨUU должен составлять ~ 1% ( SI, приложение , рис. S7).
мРНК: несовпадение тРНК на ΨAA в сайте P, не обнаруженное
E.coli Рибосома. Наши данные показывают, что рибосома может по-разному взаимодействовать с близкими / непознанными aa-тРНК, когда Ψ присутствует в кодонах A-сайта.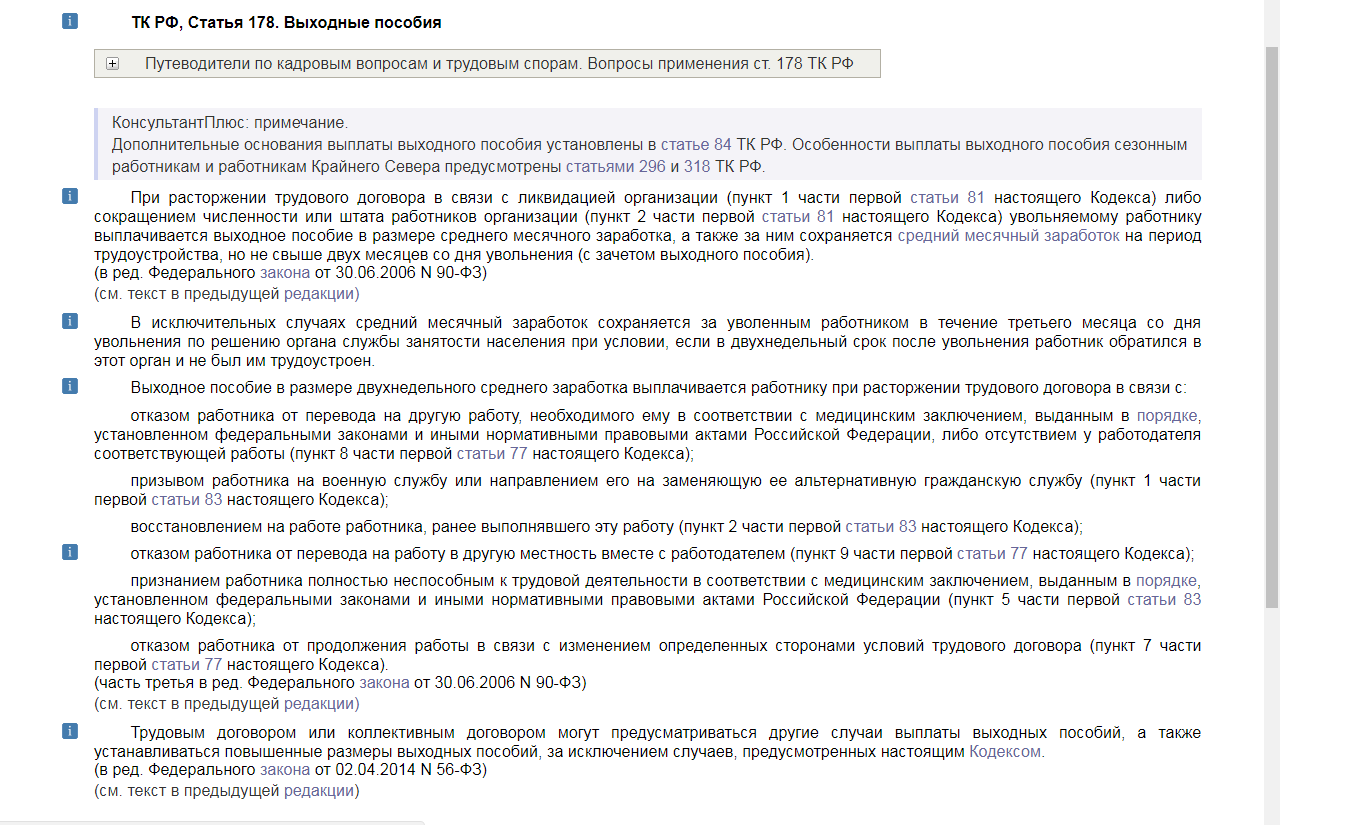 Чтобы оценить, влияет ли Ψ также на то, как рибосома воспринимает взаимодействия мРНК: тРНК в P-сайте, мы исследовали, обнаруживает ли рибосома несовпадения мРНК: тРНК на-содержащих кодонах P-сайта. На немодифицированных кодонах рибосомы E. coli воспринимают несовпадения в Р-сайтах, а факторы высвобождения 2 и 3 (RF2 / 3) катализируют гидролиз усеченных пептидов, содержащих замещенные аминокислоты, из смыслового (непрерывного) кодона для обеспечения точности трансляции (рис.5 В ) (35). Мы проверили, отслеживаются ли несовпадения, включающие псевдоуридинилированный кодон, аналогичным образом путем взаимодействия комплексов инициации рибосом, содержащих UAA или AA в сайте A, с тройными комплексами, содержащими Lys-тРНК Lys , в присутствии фактора элонгации G (EF-G). Это привело к образованию смеси несовпадающих рибосомных комплексов, содержащих либо f Met-Lys-тРНК Lys , либо f Met-Lys-Lys-тРНК Lys в сайте P (рис.
Чтобы оценить, влияет ли Ψ также на то, как рибосома воспринимает взаимодействия мРНК: тРНК в P-сайте, мы исследовали, обнаруживает ли рибосома несовпадения мРНК: тРНК на-содержащих кодонах P-сайта. На немодифицированных кодонах рибосомы E. coli воспринимают несовпадения в Р-сайтах, а факторы высвобождения 2 и 3 (RF2 / 3) катализируют гидролиз усеченных пептидов, содержащих замещенные аминокислоты, из смыслового (непрерывного) кодона для обеспечения точности трансляции (рис.5 В ) (35). Мы проверили, отслеживаются ли несовпадения, включающие псевдоуридинилированный кодон, аналогичным образом путем взаимодействия комплексов инициации рибосом, содержащих UAA или AA в сайте A, с тройными комплексами, содержащими Lys-тРНК Lys , в присутствии фактора элонгации G (EF-G). Это привело к образованию смеси несовпадающих рибосомных комплексов, содержащих либо f Met-Lys-тРНК Lys , либо f Met-Lys-Lys-тРНК Lys в сайте P (рис. 5 и SI, приложение , рис. .S11 A и B ). Затем мы добавили RF2 или RF2 / RF3 и измерили константы скорости высвобождения пептидов Met-Lys-Lys (MK) f (MK) и f Met-Lys-Lys (MKK) из этих мРНК. Если обнаружено несоответствие, мы ожидаем, что RF2 / RF3 будет катализировать преждевременное высвобождение пептида намного быстрее, чем один только RF2 (35). На немодифицированной мРНК мы наблюдали, что пептиды MK и MKK высвобождаются RF / RF3 со скоростью, сравнимой со скоростями, о которых ранее сообщалось для других несовпадающих комплексов (рис.5 и SI, приложение , рис.S11 C и D ) (35). Напротив, когда AA находится в сайте P, пептид MK не высвобождается (фиг. 5 C и SI, приложение , фиг. S11 E ). Однако, когда AA транслоцируется в сайт E, высвобождение пептида MKK катализируется RF2 / RF3; это означает, что несоответствие между тРНК Lys и кодоном GUU в P-сайте отслеживается на Ψ-содержащем транскрипте (фиг.
5 и SI, приложение , рис. .S11 A и B ). Затем мы добавили RF2 или RF2 / RF3 и измерили константы скорости высвобождения пептидов Met-Lys-Lys (MK) f (MK) и f Met-Lys-Lys (MKK) из этих мРНК. Если обнаружено несоответствие, мы ожидаем, что RF2 / RF3 будет катализировать преждевременное высвобождение пептида намного быстрее, чем один только RF2 (35). На немодифицированной мРНК мы наблюдали, что пептиды MK и MKK высвобождаются RF / RF3 со скоростью, сравнимой со скоростями, о которых ранее сообщалось для других несовпадающих комплексов (рис.5 и SI, приложение , рис.S11 C и D ) (35). Напротив, когда AA находится в сайте P, пептид MK не высвобождается (фиг. 5 C и SI, приложение , фиг. S11 E ). Однако, когда AA транслоцируется в сайт E, высвобождение пептида MKK катализируется RF2 / RF3; это означает, что несоответствие между тРНК Lys и кодоном GUU в P-сайте отслеживается на Ψ-содержащем транскрипте (фиг. S11 F ). Наши данные демонстрируют, что несовпадения мРНК: тРНК на кодонах AA P-сайта не распознаются, что позволяет предположить, что Ψ может изменять способ взаимодействия рибосомы с близкими / непознанными аа-тРНК в P-сайте.
S11 F ). Наши данные демонстрируют, что несовпадения мРНК: тРНК на кодонах AA P-сайта не распознаются, что позволяет предположить, что Ψ может изменять способ взаимодействия рибосомы с близкими / непознанными аа-тРНК в P-сайте.
Фактору высвобождения 1 (RF1) класса I незначительно препятствует присутствие.
Сообщалось, что присутствие в стоп-кодонах способствует бессмысленному подавлению, включая Ser или Thr вместо прекращения трансляции кодонов UAA, как в клетках бактерий, так и в клетках дрожжей (14, 21). Вычислительные исследования предсказывают, что это связано с изменениями активности фактора высвобождения на псевдоуридинилированных стоп-кодонах (36). Чтобы оценить, влияет ли на способность факторов высвобождения класса I катализировать гидролиз пептида из пептидил-тРНК, мы измерили константы скорости высвобождения пептида на мРНК, кодирующей метионин, за которой следует универсальный стоп-кодон (UAA / AA) (рис.5 D и E ). При насыщающих концентрациях RF1 или RF2 высвобождение пептида на кодоне UAA происходило с константами скорости ( k макс, высвобождение ) между 0,06–0,24 с –1 при 22 ° C, что согласуется с ранее опубликованными значениями (35, 37) (Рис. 5 D и E и SI Приложение , Таблица S7). Высвобождение пептида на кодоне ΨAA было лишь незначительно нарушено: k макс, высвобождение для RF1 было уменьшено в ~ 3 раза, но k макс, высвобождение для RF2 и K 1/2 для обоих RF1 и RF2 остались без изменений (рис.5 D и E и SI Приложение , рис. S12 и таблица S7). Наши результаты в основном согласуются с предыдущим исследованием с использованием RF1 и варианта RF2 A246T (38), в котором не было обнаружено различий в константах скорости высвобождения пептида на стоп-кодонах дикого типа и β-содержащих стоп-кодонах (22). Умеренное влияние на активность RF1, по-видимому, специфично для, поскольку мы находим, что m 6 A препятствует RF2‒, но не RF1‒, опосредованному высвобождению пептида ( SI, приложение , фиг. S13 и S14).Вместе это небольшое уменьшение константы скорости для катализированного высвобождения RF1, наша неспособность включить Ser на AA в отсутствие факторов высвобождения ( SI Приложение , рис.
5 D и E и SI Приложение , Таблица S7). Высвобождение пептида на кодоне ΨAA было лишь незначительно нарушено: k макс, высвобождение для RF1 было уменьшено в ~ 3 раза, но k макс, высвобождение для RF2 и K 1/2 для обоих RF1 и RF2 остались без изменений (рис.5 D и E и SI Приложение , рис. S12 и таблица S7). Наши результаты в основном согласуются с предыдущим исследованием с использованием RF1 и варианта RF2 A246T (38), в котором не было обнаружено различий в константах скорости высвобождения пептида на стоп-кодонах дикого типа и β-содержащих стоп-кодонах (22). Умеренное влияние на активность RF1, по-видимому, специфично для, поскольку мы находим, что m 6 A препятствует RF2‒, но не RF1‒, опосредованному высвобождению пептида ( SI, приложение , фиг. S13 и S14).Вместе это небольшое уменьшение константы скорости для катализированного высвобождения RF1, наша неспособность включить Ser на AA в отсутствие факторов высвобождения ( SI Приложение , рис. S15) и наша неспособность обнаружить расширенные продукты из полностью AA замещенный репортер люциферазы в системе трансляции NEB PURExpress in vitro, предполагают, что Ψ вряд ли значительно подавит терминацию трансляции в нормальных клеточных условиях.
S15) и наша неспособность обнаружить расширенные продукты из полностью AA замещенный репортер люциферазы в системе трансляции NEB PURExpress in vitro, предполагают, что Ψ вряд ли значительно подавит терминацию трансляции в нормальных клеточных условиях.
Обсуждение
Неспособность нейтрализовать ферменты, которые включают в мРНК, не влияя при этом на модификацию некодирующей РНК, в сочетании с отсутствием известных белков-ридеров или стирателей, затрудняет исследование биологических последствий модификаций мРНК.Мы подошли к этой задаче, используя полностью восстановленный анализ трансляции in vitro и спросив, как псевдоуридинилирование мРНК влияет на функцию одного возможного ридера, рибосомы. Наши исследования показывают, что присутствие в кодонах незначительно изменяет то, как рибосома взаимодействует как с родственными, так и с неконференционными / близкими к аа-тРНК. Мы наблюдали, что β-содержащие кодоны нарушают трансляцию родственных кодонов и способствуют синтезу различных пептидных продуктов из одной мРНК чаще, чем из немодифицированных мРНК, как в реконструированной бактериальной системе трансляции, так и в клетках человека.
Рассмотрение наших кинетических и структурных данных в отношении установленной механистической парадигмы для связывания aa-тРНК с сайтом A ( SI Приложение , Fig. S3) (23) дает некоторое представление о механистических эффектах Ψ. Мы наблюдали снижение констант скорости добавления аминокислот ( k obs ) и GTP-гидролиза, катализируемого EF-Tu ( k GTP ) на Ψ-содержащих кодонах, что согласуется с нашим выводом о том, что-замещенные кодоны снизить общую скорость производства полноразмерного белка.Изменения в зависимости от k obs , k GTP и Mg (II) в наших наблюдениях ( SI Приложение , рис. S16) напоминают те, которые наблюдались для близкородственных тРНК (33), хотя и более тонко, предполагая, что распознавание псевдоуридинилированных кодонов существует где-то в спектре между родственными и почти родственными комплексами. Наши структурные данные предоставляют дополнительные доказательства того, что рибосома по-разному взаимодействует с тРНК, связанными с-содержащими кодонами. Мы обнаружили, что 3′-CCA тРНК A-сайта становится неупорядоченным, что позволяет предположить, что нетрадиционное декодирование кодона ΨUU A-сайта в центре декодирования в малой субъединице рибосомы приводит к дальнодействующим изменениям в акцепторном стволе A -сайтовая тРНК, расположенная в PTC на большой субъединице рибосомы.Взятые в целом, наши кинетические и структурные результаты показывают, что незначительно влияет на несколько этапов кинетического пути трансляции, оказывая общий наблюдаемый эффект на добавление аминокислот.
Мы обнаружили, что 3′-CCA тРНК A-сайта становится неупорядоченным, что позволяет предположить, что нетрадиционное декодирование кодона ΨUU A-сайта в центре декодирования в малой субъединице рибосомы приводит к дальнодействующим изменениям в акцепторном стволе A -сайтовая тРНК, расположенная в PTC на большой субъединице рибосомы.Взятые в целом, наши кинетические и структурные результаты показывают, что незначительно влияет на несколько этапов кинетического пути трансляции, оказывая общий наблюдаемый эффект на добавление аминокислот.
Наши кинетические и масс-спектрометрические данные показывают, что, хотя аминокислотная замена увеличивается в присутствии, эти события относительно редки в нестрессированных клетках (<1,5%). Более того, многие аминокислотные замены, вероятно, будут нейтральными, поэтому не следует ожидать, что включение в мРНК приведет к образованию значительных количеств нефункционального белка в нормальных клеточных условиях.Тем не менее, могут быть некоторые условия или контексты последовательностей, в которых-опосредованная замена аминокислот происходит более устойчиво. Наше наблюдение, что изменяет декодирование рибосомой в клетках, отличается от предыдущих исследований на основе репортеров, в которых не наблюдались аминокислотные замены в одном определенном положении в полноразмерном репортерном пептиде ErmCL или в полностью-замещенном репортере GFP (16 , 17). Есть несколько возможных объяснений этого несоответствия. Во-первых, наши масс-спектрометрические анализы смогли обнаружить множественные события аминокислотных замен in vivo, которые происходили с частотами (0.1–0,4%; SI Приложение , таблицы S5 и S6) ниже, чем заявленный предел обнаружения для исследования GFP (~ 1%). Во-вторых, влияние на декодирование может сильно зависеть от локальной последовательности и структуры мРНК (39). Это было бы неудивительно, учитывая, что наши исследования показывают, что степень включения альтернативной аминокислоты зависит как от идентичности кодона, так и от положения нуклеотида в кодоне (рис. 3). Такая зависимость от контекста ранее наблюдалась для инозина; как декодируется инозин, так и частота аминокислотных замен (0.
Наше наблюдение, что изменяет декодирование рибосомой в клетках, отличается от предыдущих исследований на основе репортеров, в которых не наблюдались аминокислотные замены в одном определенном положении в полноразмерном репортерном пептиде ErmCL или в полностью-замещенном репортере GFP (16 , 17). Есть несколько возможных объяснений этого несоответствия. Во-первых, наши масс-спектрометрические анализы смогли обнаружить множественные события аминокислотных замен in vivo, которые происходили с частотами (0.1–0,4%; SI Приложение , таблицы S5 и S6) ниже, чем заявленный предел обнаружения для исследования GFP (~ 1%). Во-вторых, влияние на декодирование может сильно зависеть от локальной последовательности и структуры мРНК (39). Это было бы неудивительно, учитывая, что наши исследования показывают, что степень включения альтернативной аминокислоты зависит как от идентичности кодона, так и от положения нуклеотида в кодоне (рис. 3). Такая зависимость от контекста ранее наблюдалась для инозина; как декодируется инозин, так и частота аминокислотных замен (0. 5–25%) широко варьируются в зависимости от контекста последовательности (40). В-третьих, клеточные стрессы изменяют доступный пул аа-тРНК и распределение модификаций мРНК (7, 41). Степень аминокислотной замены должна быть очень чувствительной к относительным уровням аа-тРНК, поэтому различные клеточные условия, вероятно, будут влиять на степень аминокислотной замены. Наконец, возможно, что возможность наблюдения альтернативного декодирования в различных мРНК может быть совершенно различной на основании идентичности мРНК и посттрансляционной судьбы замещенного аминокислотой пептида.
5–25%) широко варьируются в зависимости от контекста последовательности (40). В-третьих, клеточные стрессы изменяют доступный пул аа-тРНК и распределение модификаций мРНК (7, 41). Степень аминокислотной замены должна быть очень чувствительной к относительным уровням аа-тРНК, поэтому различные клеточные условия, вероятно, будут влиять на степень аминокислотной замены. Наконец, возможно, что возможность наблюдения альтернативного декодирования в различных мРНК может быть совершенно различной на основании идентичности мРНК и посттрансляционной судьбы замещенного аминокислотой пептида.
Мы наблюдали, что-содержащие кодоны умеренно влияют на способность рибосомы включать Phe, в соответствии с нашими исследованиями ( SI Приложение , рис. S2) и другими, демонстрирующими, что общая продукция белка снижается за счет репортеров мРНК, содержащих либо одно- (<2-кратно) (16, 17), либо полностью -замещенные кодоны (3-кратно) в полностью восстановленной системе трансляции E. coli и клетках человека (17). Мы предполагаем, что влияние на скорость трансляции кодона может зависеть от контекста последовательности кодона; мы видели, что включение в различные последовательности мРНК, кодирующие идентичные пептиды люциферазы, может иметь очень разные результаты экспрессии белка в клетках 293H ( SI Приложение , рис.S17). В целом, наши результаты сходны с тем, что было сообщено для декодирования m 6 A и 2 ‘O-метил содержащих кодонов (32, 42), предполагая, что модификации мРНК могут в целом изменять связывание и аккомодацию aa-тРНК. Учитывая склонность рибосомы реагировать с близкими и нераспознанными аа-тРНК во время трансляции-содержащих мРНК (рис.3 и 4), эти небольшие дефекты скорости могут стать важными для отбора родственных аа-тРНК в условиях клеточного стресса. или голодание.Мы предполагаем, что клеткам может быть выгодно поддерживать небольшой резервуар разнообразия белков для эволюции и адаптации к стрессам окружающей среды (43, 44). Действительно, было показано, что повышенные уровни аминокислотных замен повышают приспособленность клеток при окислительном и температурном стрессе, а также при переходе от стационарных условий к условиям роста клеток (45–47).
Мы предполагаем, что влияние на скорость трансляции кодона может зависеть от контекста последовательности кодона; мы видели, что включение в различные последовательности мРНК, кодирующие идентичные пептиды люциферазы, может иметь очень разные результаты экспрессии белка в клетках 293H ( SI Приложение , рис.S17). В целом, наши результаты сходны с тем, что было сообщено для декодирования m 6 A и 2 ‘O-метил содержащих кодонов (32, 42), предполагая, что модификации мРНК могут в целом изменять связывание и аккомодацию aa-тРНК. Учитывая склонность рибосомы реагировать с близкими и нераспознанными аа-тРНК во время трансляции-содержащих мРНК (рис.3 и 4), эти небольшие дефекты скорости могут стать важными для отбора родственных аа-тРНК в условиях клеточного стресса. или голодание.Мы предполагаем, что клеткам может быть выгодно поддерживать небольшой резервуар разнообразия белков для эволюции и адаптации к стрессам окружающей среды (43, 44). Действительно, было показано, что повышенные уровни аминокислотных замен повышают приспособленность клеток при окислительном и температурном стрессе, а также при переходе от стационарных условий к условиям роста клеток (45–47). Идея о том, что уровни аминокислотных замен могут варьироваться в зависимости от клеточных условий, подтверждается недавним исследованием, демонстрирующим, что частота аминокислотных замен в клетках E.coli EF-Tu варьируется на 2 порядка в зависимости от уровня экспрессии белка (34). В конечном счете, для понимания того, как одна модификация связана со стабильностью мРНК и синтезом белка в клетке, потребуется полный набор современных научных инструментов, включая ансамблевую и одномолекулярную биохимию, глубокое секвенирование и клеточную биологию.
Идея о том, что уровни аминокислотных замен могут варьироваться в зависимости от клеточных условий, подтверждается недавним исследованием, демонстрирующим, что частота аминокислотных замен в клетках E.coli EF-Tu варьируется на 2 порядка в зависимости от уровня экспрессии белка (34). В конечном счете, для понимания того, как одна модификация связана со стабильностью мРНК и синтезом белка в клетке, потребуется полный набор современных научных инструментов, включая ансамблевую и одномолекулярную биохимию, глубокое секвенирование и клеточную биологию.
Материалы и методы
Рибосомы 70S с жесткой парой были очищены от E. coli MRE600. Немодифицированные мРНК получали транскрипцией T7 ДНК-олигонуклеотидов.мРНК, содержащие модифицированные нуклеотиды, были синтезированы и очищены ВЭЖХ с помощью Dharmacon, и их качество оценивалось с помощью УВЭЖХ-МС / МС ( SI Приложение , рис. S18). РНК для переноса E. coli были приобретены либо у MP Biomedical, Sigma, либо у тРНК Probes. Все эксперименты по трансляции проводили в буфере 1 × 219-Трис (50 мМ Трис pH 7,5, 70 мМ NH 4 Cl, 30 мМ KCl, 7 мМ MgCl 2 , 5 мМ β-ME), как описано ранее (25, 35). Инициирующие комплексы очищали ультрацентрифугированием.Подробные процедуры и условия реакции для всех экспериментов приведены в Приложении SI .
Все эксперименты по трансляции проводили в буфере 1 × 219-Трис (50 мМ Трис pH 7,5, 70 мМ NH 4 Cl, 30 мМ KCl, 7 мМ MgCl 2 , 5 мМ β-ME), как описано ранее (25, 35). Инициирующие комплексы очищали ультрацентрифугированием.Подробные процедуры и условия реакции для всех экспериментов приведены в Приложении SI .
Доступность данных.
Координаты и структурные факторы были депонированы в банке данных белков RCSB.
Благодарности
Эта работа финансировалась стартовыми фондами Мичиганского университета (для KSK), Rackham Merit Fellowship (для MKF), наградами Национальных институтов здравоохранения R35 GM128836 (для KSK), T32 GM008597 (для MKF), Фонды стартапов Университета Иллинойса (Ю.S.P.) и New England Biolabs (NEB) Inc. (M.Z.W. и B.R. — сотрудники New England Biolabs, Inc.). Структурные работы основаны на исследованиях, проводимых Северо-восточной группой коллективного доступа, которые финансируются Национальным институтом общих медицинских наук Национальными институтами здравоохранения [P30-GM124165 до NE-CAT]. Детектор Pilatus 6M на канале 24ID-C финансируется NIH-ORIP HEI [S10-RR029205 — NE-CAT]. Детектор Eiger 16M на канале 24ID-E финансируется грантом NIH-ORIP HEI [S10-OD021527 to NE-CAT].В этом исследовании использовались ресурсы Advanced Photon Source, Управления науки Министерства энергетики США (DOE), используемого для Управления науки DOE Аргоннской национальной лабораторией по контракту № DE-AC02-06Ch21357. Мы благодарим сотрудников NE-CAT каналов 24ID-C и 24ID-E за помощь в сборе данных и замораживании кристаллов. Мы также благодарим доктора Рэйчел Грин за предоставление плазмид фактора трансляции, доктора Роберта Кеннеди за использование его ВЭЖХ и масс-спектрометра, а также Скотта Шаффера и Маркоса Кутмоса за их комментарии к рукописи.
Детектор Pilatus 6M на канале 24ID-C финансируется NIH-ORIP HEI [S10-RR029205 — NE-CAT]. Детектор Eiger 16M на канале 24ID-E финансируется грантом NIH-ORIP HEI [S10-OD021527 to NE-CAT].В этом исследовании использовались ресурсы Advanced Photon Source, Управления науки Министерства энергетики США (DOE), используемого для Управления науки DOE Аргоннской национальной лабораторией по контракту № DE-AC02-06Ch21357. Мы благодарим сотрудников NE-CAT каналов 24ID-C и 24ID-E за помощь в сборе данных и замораживании кристаллов. Мы также благодарим доктора Рэйчел Грин за предоставление плазмид фактора трансляции, доктора Роберта Кеннеди за использование его ВЭЖХ и масс-спектрометра, а также Скотта Шаффера и Маркоса Кутмоса за их комментарии к рукописи.
Сноски
Вклад авторов: D.E.E., M.K.F., Z.B., M.Z.W., M.L.D., Y.S.P., B.R. и K.S.K. спланированное исследование; D.E.E., M.K.F., Z.B., M.Z.W., M.L.D., M.D.-B., J.D.J. и B.R. проведенное исследование; J.D.J. внесены новые реагенты / аналитические инструменты; D.
 E.E., M.K.F., Z.B., M.Z.W., M.L.D., Y.S.P., B.R. и K.S.K. проанализированные данные; и D.E.E., M.K.F., Z.B., M.Z.W., Y.S.P., B.R. и K.S.K. написал газету.
E.E., M.K.F., Z.B., M.Z.W., M.L.D., Y.S.P., B.R. и K.S.K. проанализированные данные; и D.E.E., M.K.F., Z.B., M.Z.W., Y.S.P., B.R. и K.S.K. написал газету.Авторы заявляют об отсутствии конкурирующей заинтересованности.
Эта статья представляет собой прямое представление PNAS.
Размещение данных: Координаты и структурные факторы были депонированы в банке данных белков RCSB с кодом доступа 6OU1 для рибосомы Thermus thermophilus 70S в комплексе с ΨUU-мРНК, тРНК A-, P- и E-сайта.
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1821754116/-/DCSupplemental.
Границы | tmRNA-опосредованная транс-трансляция как основная система спасения рибосом в бактериальной клетке
Введение
Перевод часто останавливается в различных ситуациях в камере, иногда запрограммированно, а иногда неожиданно.Например, трансляция мРНК, лишенной стоп-кодона (нон-стоп-кодон), не прекращается эффективно, потому что фактор высвобождения пептида не функционирует. Таким образом, в ячейке должна быть система, способная справиться с такими чрезвычайными ситуациями. Однако до середины 1990-х этому вопросу уделялось мало внимания, и поэтому открытие тмРНК стало большим сюрпризом. Первоначально были выяснены тРНК-подобная структура и функция тмРНК. Обе концевые области тмРНК могут образовывать вторичную структуру, напоминающую верхнюю половину структуры тРНК, напоминающей клеверный лист (Komine et al., 1994; Ushida et al., 1994), который включает несколько консенсусных последовательностей, специфичных для тРНК, и модификаций оснований (Рисунок 1A; Felden et al., 1997, 1998). Как и у тРНК, 3′-конец тмРНК может быть аминоацилирован аминокислотой (аланином) аминоацил-тРНК-синтетазой (аланил-тРНК-синтетазой; Komine et al., 1994; Ushida et al., 1994). Другие тРНК-подобные функции, такие как 5′-процессинг РНКазой P (Komine et al., 1994), связывание с EF-Tu (Rudinger-Thirion et al., 1999; Barends et al., 2000, 2001; Hanawa-Suetsugu и другие., 2001) и взаимодействие с 70S рибосомой (Ushida et al.
Таким образом, в ячейке должна быть система, способная справиться с такими чрезвычайными ситуациями. Однако до середины 1990-х этому вопросу уделялось мало внимания, и поэтому открытие тмРНК стало большим сюрпризом. Первоначально были выяснены тРНК-подобная структура и функция тмРНК. Обе концевые области тмРНК могут образовывать вторичную структуру, напоминающую верхнюю половину структуры тРНК, напоминающей клеверный лист (Komine et al., 1994; Ushida et al., 1994), который включает несколько консенсусных последовательностей, специфичных для тРНК, и модификаций оснований (Рисунок 1A; Felden et al., 1997, 1998). Как и у тРНК, 3′-конец тмРНК может быть аминоацилирован аминокислотой (аланином) аминоацил-тРНК-синтетазой (аланил-тРНК-синтетазой; Komine et al., 1994; Ushida et al., 1994). Другие тРНК-подобные функции, такие как 5′-процессинг РНКазой P (Komine et al., 1994), связывание с EF-Tu (Rudinger-Thirion et al., 1999; Barends et al., 2000, 2001; Hanawa-Suetsugu и другие., 2001) и взаимодействие с 70S рибосомой (Ushida et al. , 1994; Komine et al., 1996; Tadaki et al., 1996). Хотя она примерно в пять раз больше, чем тРНК, тмРНК не имеет явного антикодона, что затрудняет выяснение того, участвует ли тмРНК в трансляции и каким образом. Несколько лет спустя было обнаружено, что тмРНК выполняет функции не только как тРНК, но и как мРНК: короткий пептид кодируется средней частью тмРНК (Tu et al., 1995), которая окружена четырьмя структурами псевдоузлов (рис. 1A; Nameki et al., 1999б, в). Любопытно, что эти две функции взаимодействуют, а не являются независимыми, для получения химерного полипептида из двух мРНК, усеченного на С-конце полипептида, кодируемого мРНК, сливающей короткий пептид, кодируемый тмРНК, с остатком аланина неизвестного происхождения между ними (Keiler et al. al., 1996; Muto et al., 1996; Himeno et al., 1997). Эта акробатическая трансляция, включающая ко-трансляционную замену мРНК, дает единый полипептид из двух мРНК, и поэтому она была названа трансляцией транс и -трансляцией (рисунок 2; Muto et al.
, 1994; Komine et al., 1996; Tadaki et al., 1996). Хотя она примерно в пять раз больше, чем тРНК, тмРНК не имеет явного антикодона, что затрудняет выяснение того, участвует ли тмРНК в трансляции и каким образом. Несколько лет спустя было обнаружено, что тмРНК выполняет функции не только как тРНК, но и как мРНК: короткий пептид кодируется средней частью тмРНК (Tu et al., 1995), которая окружена четырьмя структурами псевдоузлов (рис. 1A; Nameki et al., 1999б, в). Любопытно, что эти две функции взаимодействуют, а не являются независимыми, для получения химерного полипептида из двух мРНК, усеченного на С-конце полипептида, кодируемого мРНК, сливающей короткий пептид, кодируемый тмРНК, с остатком аланина неизвестного происхождения между ними (Keiler et al. al., 1996; Muto et al., 1996; Himeno et al., 1997). Эта акробатическая трансляция, включающая ко-трансляционную замену мРНК, дает единый полипептид из двух мРНК, и поэтому она была названа трансляцией транс и -трансляцией (рисунок 2; Muto et al. , 1998). Эта система обеспечивает стоп-кодон, позволяющий завершить трансляцию нон-стоп мРНК и, следовательно, рециклинг рибосомы. Кроме того, трансляция транс- рассматривается как система контроля качества, которая предотвращает накопление нефункциональных полипептидов, полученных из усеченных мРНК, в качестве метки-пептида, состоящего из первого остатка аланина и короткого пептида, кодируемого тмРНК. , особенно последовательность последних четырех гидрофобных аминокислот (ALAA), служит мишенью для клеточных АТФ-зависимых протеаз (Gottesman et al., 1998; Герман и др., 1998; Флинн и др., 2001; Choy et al., 2007).
, 1998). Эта система обеспечивает стоп-кодон, позволяющий завершить трансляцию нон-стоп мРНК и, следовательно, рециклинг рибосомы. Кроме того, трансляция транс- рассматривается как система контроля качества, которая предотвращает накопление нефункциональных полипептидов, полученных из усеченных мРНК, в качестве метки-пептида, состоящего из первого остатка аланина и короткого пептида, кодируемого тмРНК. , особенно последовательность последних четырех гидрофобных аминокислот (ALAA), служит мишенью для клеточных АТФ-зависимых протеаз (Gottesman et al., 1998; Герман и др., 1998; Флинн и др., 2001; Choy et al., 2007).
РИСУНОК 1. Вторичные и третичные структуры тмРНК. (A) Вторичная структура тмРНК. (Слева) показана наиболее типичная вторичная структура тмРНК с TLD и областью, кодирующей тег, обозначенными коричневым и красным цветом соответственно. (Справа) Вторичная структура двухкомпонентной тмРНК. 5’-кодирующий фрагмент и фрагмент-акцептор 3’-аминокислоты обозначены зеленым и фиолетовым цветом соответственно. (B) Тетичная структура тмРНК или ее фрагмента в комплексе с SmpB. (Слева) Кристаллическая структура комплекса фрагмента TLD, лишенного 3’CCA-конца тмРНК T. thermophilus (5 ’25 остатков и 3′ 34 остатка, соединенных петлей UUCG) и глобулярного домена (N- терминал 123 из 144 остатков) SmpB (PDB ID: 2CZJ; Bessho et al., 2007). TLD (коричневый) и SmpB (темно-синий) имитируют верхнюю и нижнюю половины L-образной структуры тРНК соответственно. (Справа) Крио-ЭМ структура тмРНК · SmpB в T.thermophilus комплекс посттранслоцированного состояния трансляции (PDB ID: 3YIR; Weis et al., 2010b) показан с TLD, областью, кодирующей тег, и SmpB, обозначенными коричневым, красным и темно-синим цветом, соответственно. . N-концевой глобулярный домен SmpB, имитирующий нижнюю половину L-образной структуры тРНК, находится в тесном контакте с вышележащей областью последовательности, кодирующей метку.
(B) Тетичная структура тмРНК или ее фрагмента в комплексе с SmpB. (Слева) Кристаллическая структура комплекса фрагмента TLD, лишенного 3’CCA-конца тмРНК T. thermophilus (5 ’25 остатков и 3′ 34 остатка, соединенных петлей UUCG) и глобулярного домена (N- терминал 123 из 144 остатков) SmpB (PDB ID: 2CZJ; Bessho et al., 2007). TLD (коричневый) и SmpB (темно-синий) имитируют верхнюю и нижнюю половины L-образной структуры тРНК соответственно. (Справа) Крио-ЭМ структура тмРНК · SmpB в T.thermophilus комплекс посттранслоцированного состояния трансляции (PDB ID: 3YIR; Weis et al., 2010b) показан с TLD, областью, кодирующей тег, и SmpB, обозначенными коричневым, красным и темно-синим цветом, соответственно. . N-концевой глобулярный домен SmpB, имитирующий нижнюю половину L-образной структуры тРНК, находится в тесном контакте с вышележащей областью последовательности, кодирующей метку.
РИСУНОК 2. Схематическое изображение трансляции trans . Когда транслируемая рибосома останавливается из-за усечения мРНК, она восстанавливается с помощью трансляции транс , которая производит химерный белок, состоящий из усеченного на С-конце полипептида (серые кружки), кодируемого 3′-усеченной мРНК, сливающей тмРНК- кодируемый короткий пептид (синие кружки) с остатком аланина (красный кружок), происходящий от аминоацилированного аланина на 3′-конце тмРНК между ними. Trans -трансляция способствует деградации как укороченных мРНК, так и аберрантных полипептидов из укороченных мРНК.
Когда транслируемая рибосома останавливается из-за усечения мРНК, она восстанавливается с помощью трансляции транс , которая производит химерный белок, состоящий из усеченного на С-конце полипептида (серые кружки), кодируемого 3′-усеченной мРНК, сливающей тмРНК- кодируемый короткий пептид (синие кружки) с остатком аланина (красный кружок), происходящий от аминоацилированного аланина на 3′-конце тмРНК между ними. Trans -трансляция способствует деградации как укороченных мРНК, так и аберрантных полипептидов из укороченных мРНК.
Trans -трансляция требует тмРНК-связывающего белка, называемого SmpB, в дополнение к каноническим факторам элонгации (Karzai et al., 1999). SmpB состоит из глобулярного домена и неструктурированного C-концевого хвоста (Dong et al., 2002; Someya et al., 2003). Он связывается с тРНК-подобным доменом (TLD) тмРНК для предотвращения деградации тмРНК и усиления аминоацилирования тмРНК (Barends et al., 2001; Hanawa-Suetsugu et al. , 2002; Shimizu and Ueda, 2002; Nameki et al. , 2005). SmpB также играет решающую роль в рибосомном процессе трансляции транс .
, 2002; Shimizu and Ueda, 2002; Nameki et al. , 2005). SmpB также играет решающую роль в рибосомном процессе трансляции транс .
Система трансляции транс- повсеместно присутствует в бактериальных клетках и присутствует в органеллах некоторых эукариот, но не в цитоплазме эукариот или архебактерий. Накапливаются данные, указывающие на то, что бактериальная клетка оснащена дополнительными системами, позволяющими справиться с остановкой трансляции. Здесь мы рассматриваем текущее понимание молекулярного механизма и клеточных функций тмРНК-опосредованной трансляции trans , а также других систем спасения рибосом.
Молекулярный механизм
Trans — перевод Схема процесса трансляции trans выглядит следующим образом (Рисунок 3): первоначально тмРНК в комплексе с SmpB аминоацилируется с аланином аланил-тРНК синтетазой. Ala-тмРНК входит в A-сайт остановившейся рибосомы на усеченной мРНК, чтобы получить растущий полипептид из пептидил-тРНК в P-сайте. Затем пептидил-Ala-тмРНК перемещается в Р-сайт, который заменяет матрицу усеченной мРНК на кодирующую метку область на тмРНК.Это может разумно объяснить отсутствие происхождения остатка аланина, соединяющего усеченный полипептид, кодируемый мРНК, с кодируемым тмРНК tag-пептидом: он происходит от остатка аланина, аминоацилированного в тмРНК. Эта модель была предложена на основе результатов исследования in vivo , показывающего, что усеченные полипептиды, сливающие тмРНК-кодирующий таг-пептид на его С-концах, накапливаются в клетке при экспрессии усеченной мРНК (Keiler et al., 1996), и модель была подтверждена результатами исследования in vitro , показывающего, что tag-пептид синтезируется с использованием экстракта клеток Escherichia coli в зависимости от добавления поли (U) и от способности тмРНК к аминоацилированию ( Muto et al., 1996; Himeno et al., 1997). Однако возник ряд вопросов. Как тмРНК находит остановившуюся рибосому? Как тмРНК попадает в А-сайт рибосомы без антикодона? Каким образом кодирующая метка область тмРНК заменяет усеченную мРНК? Как определяется точка возобновления на тмРНК? SmpB стал ключевой молекулой для решения этих вопросов.
Затем пептидил-Ala-тмРНК перемещается в Р-сайт, который заменяет матрицу усеченной мРНК на кодирующую метку область на тмРНК.Это может разумно объяснить отсутствие происхождения остатка аланина, соединяющего усеченный полипептид, кодируемый мРНК, с кодируемым тмРНК tag-пептидом: он происходит от остатка аланина, аминоацилированного в тмРНК. Эта модель была предложена на основе результатов исследования in vivo , показывающего, что усеченные полипептиды, сливающие тмРНК-кодирующий таг-пептид на его С-концах, накапливаются в клетке при экспрессии усеченной мРНК (Keiler et al., 1996), и модель была подтверждена результатами исследования in vitro , показывающего, что tag-пептид синтезируется с использованием экстракта клеток Escherichia coli в зависимости от добавления поли (U) и от способности тмРНК к аминоацилированию ( Muto et al., 1996; Himeno et al., 1997). Однако возник ряд вопросов. Как тмРНК находит остановившуюся рибосому? Как тмРНК попадает в А-сайт рибосомы без антикодона? Каким образом кодирующая метка область тмРНК заменяет усеченную мРНК? Как определяется точка возобновления на тмРНК? SmpB стал ключевой молекулой для решения этих вопросов.
РИСУНОК 3. Текущая модель trans -перевод. Ala-tmRNA · SmpB · EF-Tu · GTP входит в свободный A-сайт застопорившейся рибосомы, чтобы запустить трансляцию trans -трансляции.Гидролиз GTP с помощью EF-Tu может вызывать изменение конформации застопорившегося комплекса, позволяя C-концевому хвосту SmpB взаимодействовать с путем мРНК с расширенной структурой. После переноса пептидила пептидил-Ala-tmRNA · SmpB перемещается с A-сайта на P-сайт с помощью EF-G, чтобы вытеснить укороченную мРНК из рибосомы. При этом удлиненный С-концевой хвост как-то складывается. Затем кодон возобновления тмРНК устанавливается в области декодирования. SmpB и область кодирования тегов показаны красным и синим цветом соответственно.
Помимо канонических факторов трансляции и tmRNA, SmpB является минимальным требованием для трансляции in vitro транс- (Shimizu and Ueda, 2002; Takada et al., 2007; Kurita et al., 2012). Считается, что SmpB продолжает связываться с тмРНК на протяжении всего процесса трансляции транс- (Иванова и др.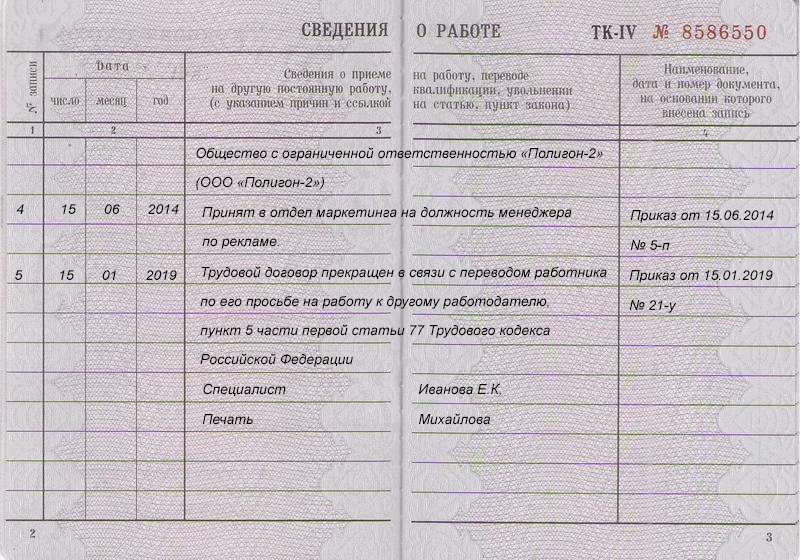 , 2007). В кристаллической структуре комплекса SmpB и модельного фрагмента РНК, соответствующего TLD тмРНК, глобулярный домен SmpB связывается с TLD, так что он компенсирует отсутствие нижней половины структуры L-формы в тмРНК (рис. 1B). ; Gutmann et al., 2003; Бесшо и др., 2007). Таким образом, TLD в комплексе с глобулярным доменом SmpB структурно имитирует целую молекулу тРНК. Исследование направленного исследования гидроксильных радикалов выявило два сайта связывания SmpB в рибосоме E. coli , один в A-сайте, а другой в P-сайте, оба из которых могут быть наложены на нижнюю половину молекул тРНК. в транслирующей рибосоме (Kurita et al., 2007). Дополнительная мимикрия верхней половины тРНК с помощью TLD может завершить две полные трансляции мимики тРНК в A-сайте и P-сайте, так что их аминоацильные концы ориентированы к центру пептидилтрансферазы.Характер расщепления 16S рРНК гидроксильными радикалами от остатков С-концевого хвоста позволяет предположить наличие двух сайтов связывания С-концевого хвоста SmpB с двумя различными способами конформации в рибосоме в дополнение к неструктурированной конформации в растворе: протяженный конформация от A-сайта до нисходящего туннеля вдоль пути мРНК в виде α-спиральной структуры и свернутой конформации вокруг пути мРНК в P-сайте (Kurita et al.
, 2007). В кристаллической структуре комплекса SmpB и модельного фрагмента РНК, соответствующего TLD тмРНК, глобулярный домен SmpB связывается с TLD, так что он компенсирует отсутствие нижней половины структуры L-формы в тмРНК (рис. 1B). ; Gutmann et al., 2003; Бесшо и др., 2007). Таким образом, TLD в комплексе с глобулярным доменом SmpB структурно имитирует целую молекулу тРНК. Исследование направленного исследования гидроксильных радикалов выявило два сайта связывания SmpB в рибосоме E. coli , один в A-сайте, а другой в P-сайте, оба из которых могут быть наложены на нижнюю половину молекул тРНК. в транслирующей рибосоме (Kurita et al., 2007). Дополнительная мимикрия верхней половины тРНК с помощью TLD может завершить две полные трансляции мимики тРНК в A-сайте и P-сайте, так что их аминоацильные концы ориентированы к центру пептидилтрансферазы.Характер расщепления 16S рРНК гидроксильными радикалами от остатков С-концевого хвоста позволяет предположить наличие двух сайтов связывания С-концевого хвоста SmpB с двумя различными способами конформации в рибосоме в дополнение к неструктурированной конформации в растворе: протяженный конформация от A-сайта до нисходящего туннеля вдоль пути мРНК в виде α-спиральной структуры и свернутой конформации вокруг пути мРНК в P-сайте (Kurita et al. , 2007, 2010).
, 2007, 2010).
На основе этих свойств SmpB процесс трансляции trans может быть описан более подробно (Рисунок 3).Ala-tmRNA · SmpB · EF-Tu · GTP входит в свободный A-сайт застопорившейся рибосомы. Гидролиз GTP индуцирует конформационное изменение застопорившегося комплекса с высвобождением EF-Tu.GDP, делая возможным размещение Ala-TLD · SmpB в A-сайте. Во время этого процесса C-концевой хвост SmpB взаимодействует с путем мРНК, идущим к каналу входа мРНК. Впоследствии Ala-TLD в A-сайте получает растущую полипептидную цепь из пептидил-тРНК в P-сайте, и полученный пептидил-Ala-TLD · SmpB перемещается с A-сайта на P-сайт.Во время этого процесса С-концевой хвост SmpB диссоциирует от входного канала мРНК и связывается вокруг сайта кодон-антикодонного взаимодействия в Р-сайте с изменением его конформации от протяженной структуры к складчатой, что, в свою очередь, способствует высвобождение мРНК из рибосомы. Конформационное изменение C-концевого хвоста, сопровождающееся транслокацией, делает A-сайт свободным, что позволяет ввести кодон возобновления тмРНК в область декодирования. Эта модель была подтверждена результатами структурных исследований нескольких промежуточных продуктов трансляции транс и .Крио-ЭМ-исследования выявили три типа промежуточных продуктов в предварительно адаптированных, адаптированных и перемещенных состояниях (Kaur et al., 2006; Cheng et al., 2010; Fu et al., 2010; Weis et al., 2010a, б). Во всех из них SmpB и TLD занимают соответственно нижнюю и верхнюю половины сайтов связывания тРНК. Хотя С-концевой хвост SmpB не был идентифицирован на этих картах из-за низкого разрешения, его взаимодействие с путём мРНК было ясно показано в кристаллической структуре комплекса состояния преаккомодации трансляции транс-, содержащего кирромицин ( Neubauer et al., 2012).
Эта модель была подтверждена результатами структурных исследований нескольких промежуточных продуктов трансляции транс и .Крио-ЭМ-исследования выявили три типа промежуточных продуктов в предварительно адаптированных, адаптированных и перемещенных состояниях (Kaur et al., 2006; Cheng et al., 2010; Fu et al., 2010; Weis et al., 2010a, б). Во всех из них SmpB и TLD занимают соответственно нижнюю и верхнюю половины сайтов связывания тРНК. Хотя С-концевой хвост SmpB не был идентифицирован на этих картах из-за низкого разрешения, его взаимодействие с путём мРНК было ясно показано в кристаллической структуре комплекса состояния преаккомодации трансляции транс-, содержащего кирромицин ( Neubauer et al., 2012).
Эта модель может объяснить, почему трансляция транс преимущественно происходит на рибосоме, остановленной на мРНК с более коротким 3′-удлинением, что было проиллюстрировано in vitro (Иванова и др., 2004; Асано и др., 2005) : С-концевой хвост SmpB конкурирует с 3′-удлинением мРНК за канал входа мРНК. Исследование химического следа показало, что SmpB взаимодействует с A1492, A1493 и G530 в 16S рРНК, которые образуют область декодирования (Nonin-Lecomte et al., 2009). Однако эти нуклеотиды могут быть изменены без потери как пептидил-трансферазы, так и гидролитической активности GTP при трансляции транс , что указывает на гораздо более низкую значимость этих декодирующих нуклеотидов для трансляции транс (Miller et al., 2011). В кристаллической структуре комплекса Thermus thermophilus пре-аккомодации -трансляции G530 складывается с остатком (Y127) вокруг начала С-концевого хвоста SmpB (Neubauer et al., 2012). Недавно Миллер и Бускирк (2014) обнаружили, что соответствующий остаток в E. coli SmpB (h236) играет решающую роль в гидролизе GTP, что привело к предположению, что укладка этого остатка с G530 запускает гидролиз GTP.
Исследование химического следа показало, что SmpB взаимодействует с A1492, A1493 и G530 в 16S рРНК, которые образуют область декодирования (Nonin-Lecomte et al., 2009). Однако эти нуклеотиды могут быть изменены без потери как пептидил-трансферазы, так и гидролитической активности GTP при трансляции транс , что указывает на гораздо более низкую значимость этих декодирующих нуклеотидов для трансляции транс (Miller et al., 2011). В кристаллической структуре комплекса Thermus thermophilus пре-аккомодации -трансляции G530 складывается с остатком (Y127) вокруг начала С-концевого хвоста SmpB (Neubauer et al., 2012). Недавно Миллер и Бускирк (2014) обнаружили, что соответствующий остаток в E. coli SmpB (h236) играет решающую роль в гидролизе GTP, что привело к предположению, что укладка этого остатка с G530 запускает гидролиз GTP.
EF-G способствует высвобождению укороченной мРНК из застопорившейся рибосомы после переноса пептидила на Ala-tmRNA, что позволяет предположить наличие канонической транслокационной стадии в процессе транслокации trans -трансляции (Иванова и др. , 2005).Во время этого события SmpB должен пройти через барьер между A-сайтом и P-сайтом, а тмРНК должна войти внутрь канала входа мРНК, чтобы установить кодон возобновления в области декодирования. Соответственно, на крио-ЭМ карте транслокационного промежуточного комплекса, содержащего EF-G и фузидиевую кислоту, оба моста B1a, которые служат барьером между A-сайтом и P-сайтом, и защелка, которая обычно закрывается взаимодействием между головой (спираль 34) и телом (область G530), чтобы сформировать туннель мРНК, открыты (Ramrath et al., 2012). Точное позиционирование кодона возобновления в области декодирования требует наличия последовательности непосредственно перед кодоном возобновления в положениях от –6 до +1 (Williams et al., 1999; Lee et al., 2001), и эта последовательность распознается глобулярным кодоном. домен SmpB (Konno et al., 2007), предполагая, что SmpB соединяет два отдельных домена tmRNA в P-сайте, чтобы определить кодон возобновления для трансляции тегов, предположительно сразу после транслокации.
, 2005).Во время этого события SmpB должен пройти через барьер между A-сайтом и P-сайтом, а тмРНК должна войти внутрь канала входа мРНК, чтобы установить кодон возобновления в области декодирования. Соответственно, на крио-ЭМ карте транслокационного промежуточного комплекса, содержащего EF-G и фузидиевую кислоту, оба моста B1a, которые служат барьером между A-сайтом и P-сайтом, и защелка, которая обычно закрывается взаимодействием между головой (спираль 34) и телом (область G530), чтобы сформировать туннель мРНК, открыты (Ramrath et al., 2012). Точное позиционирование кодона возобновления в области декодирования требует наличия последовательности непосредственно перед кодоном возобновления в положениях от –6 до +1 (Williams et al., 1999; Lee et al., 2001), и эта последовательность распознается глобулярным кодоном. домен SmpB (Konno et al., 2007), предполагая, что SmpB соединяет два отдельных домена tmRNA в P-сайте, чтобы определить кодон возобновления для трансляции тегов, предположительно сразу после транслокации. Это согласуется с крио-ЭМ картами комплексов перемещенного состояния транс-трансляции (Рисунок 1B; Fu et al., 2010; Weis et al., 2010b). Другое исследование подтвердило важность C-концевого хвоста SmpB и его взаимодействия со стартовым кодоном GCA на тмРНК для определения начальной точки трансляции тег-пептид (Camenares et al., 2013). Взятые вместе, результаты предполагают, что взаимодействие между тмРНК и SmpB более важно для определения точки возобновления, чем взаимодействие между тмРНК и рибосомой. Следует отметить, что некоторые виды аминогликозидов, которые связывают область декодирования, смещают точку возобновления трансляции тегов (Takahashi et al., 2003; Конно и др., 2004).
Это согласуется с крио-ЭМ картами комплексов перемещенного состояния транс-трансляции (Рисунок 1B; Fu et al., 2010; Weis et al., 2010b). Другое исследование подтвердило важность C-концевого хвоста SmpB и его взаимодействия со стартовым кодоном GCA на тмРНК для определения начальной точки трансляции тег-пептид (Camenares et al., 2013). Взятые вместе, результаты предполагают, что взаимодействие между тмРНК и SmpB более важно для определения точки возобновления, чем взаимодействие между тмРНК и рибосомой. Следует отметить, что некоторые виды аминогликозидов, которые связывают область декодирования, смещают точку возобновления трансляции тегов (Takahashi et al., 2003; Конно и др., 2004).
Хотя сообщалось о нескольких примерах потенциальной молекулярной мимикрии тРНК фактором трансляции, SmpB является единственной молекулой, которая, как предполагалось, имитирует динамическое поведение тРНК во всех классических и гибридных состояниях, A / T, A / A, A / P, P / P и P / E в транслирующей рибосоме. Считается, что рибосомный белок S1, который был идентифицирован как тмРНК-связывающий белок (Wower et al., 2000), не участвует в ранней стадии трансляции trans , по крайней мере, до первой транслокации (Qi et al. ., 2007; Такада и др., 2007).
Считается, что рибосомный белок S1, который был идентифицирован как тмРНК-связывающий белок (Wower et al., 2000), не участвует в ранней стадии трансляции trans , по крайней мере, до первой транслокации (Qi et al. ., 2007; Такада и др., 2007).
Требование расщепления мРНК для
Trans -Translation Поскольку последовательность тега служит сигналом деградации, продукты трансляции trans вряд ли обнаруживаются в клетке или ее экстракте, хотя они накапливаются и, таким образом, обнаруживаются при конструировании последовательности тмРНК, кодирующей тег. С момента публикации результатов более раннего исследования in vivo с использованием искусственная мРНК (Keiler et al., 1996). Нон-стоп мРНК может быть произведена неожиданно или запрограммированным образом, и аналогичная ситуация может также возникнуть, когда нормальный кодон терминации считывается в присутствии несмысловой супрессорной тРНК (Ueda et al., 2002) или неправильное кодирование препарата (Abo et al. , 2002). Протеомный анализ выявил эндогенные продукты трансляции транс из различных бактериальных источников, что указывает на то, что трансляция транс преимущественно происходит в определенных сайтах конкретных мРНК (Roche and Sauer, 2001; Collier et al., 2002; Fujihara et al., 2002; Hong et al., 2007; Барендс и др., 2010). Следовательно, несколько ситуаций, которые способствуют трансляции транс- в середине мРНК, были сосредоточены на: приостановке трансляции из-за редкого кодона (Roche and Sauer, 1999), неэффективного терминирующего кодона (Roche and Sauer, 2001; Hayes et al. ., 2002a; Sunohara et al., 2002), а запрограммированная задерживающая последовательность (Collier et al., 2004) индуцирует трансляцию транс-. Однако вопрос о том, действительно ли происходит трансляция trans в середине мРНК без расщепления, остается спорным.Было обнаружено, что бактериальный токсин RelE расщепляет мРНК специфически в A-сайте застопорившейся рибосомы (Pedersen et al.
, 2002). Протеомный анализ выявил эндогенные продукты трансляции транс из различных бактериальных источников, что указывает на то, что трансляция транс преимущественно происходит в определенных сайтах конкретных мРНК (Roche and Sauer, 2001; Collier et al., 2002; Fujihara et al., 2002; Hong et al., 2007; Барендс и др., 2010). Следовательно, несколько ситуаций, которые способствуют трансляции транс- в середине мРНК, были сосредоточены на: приостановке трансляции из-за редкого кодона (Roche and Sauer, 1999), неэффективного терминирующего кодона (Roche and Sauer, 2001; Hayes et al. ., 2002a; Sunohara et al., 2002), а запрограммированная задерживающая последовательность (Collier et al., 2004) индуцирует трансляцию транс-. Однако вопрос о том, действительно ли происходит трансляция trans в середине мРНК без расщепления, остается спорным.Было обнаружено, что бактериальный токсин RelE расщепляет мРНК специфически в A-сайте застопорившейся рибосомы (Pedersen et al. , 2003). RelE обычно инактивируется антитоксином, RelB, и активируется за счет деградации RelB протеазой Lon при аминокислотном голодании. Тем не менее, открытие эндорибонуклеазы, специфичной для A-сайта, подтвердило идею о том, что расщепление мРНК является предпосылкой для трансляции транс и . Торможение рибосом вызывает расщепление мРНК в A-сайте даже в клетке, лишенной RelE или некоторых других эндорибонуклеаз (Hayes and Sauer, 2003; Sunohara et al., 2004а, б; Li et al., 2008), что указывает на участие еще не идентифицированной рибонуклеазы или самой рибосомы в расщеплении мРНК. Также сообщалось, что 3′-5′-экзорибонуклеазная активность РНКазы II является важной предпосылкой для A-сайт-специфичного расщепления мРНК (Garza-Sánchez et al., 2009). Помимо RelE, у E. coli было идентифицировано несколько видов рибосомозависимых эндорибонуклеаз, каждая из которых имеет специфический антитоксин (Feng et al., 2013).
, 2003). RelE обычно инактивируется антитоксином, RelB, и активируется за счет деградации RelB протеазой Lon при аминокислотном голодании. Тем не менее, открытие эндорибонуклеазы, специфичной для A-сайта, подтвердило идею о том, что расщепление мРНК является предпосылкой для трансляции транс и . Торможение рибосом вызывает расщепление мРНК в A-сайте даже в клетке, лишенной RelE или некоторых других эндорибонуклеаз (Hayes and Sauer, 2003; Sunohara et al., 2004а, б; Li et al., 2008), что указывает на участие еще не идентифицированной рибонуклеазы или самой рибосомы в расщеплении мРНК. Также сообщалось, что 3′-5′-экзорибонуклеазная активность РНКазы II является важной предпосылкой для A-сайт-специфичного расщепления мРНК (Garza-Sánchez et al., 2009). Помимо RelE, у E. coli было идентифицировано несколько видов рибосомозависимых эндорибонуклеаз, каждая из которых имеет специфический антитоксин (Feng et al., 2013).
Исследования in vitro ясно показали, что трансляция транс может происходить в середине мРНК, хотя эффективность трансляции транс резко снижается с увеличением длины 3′-удлинения от остановленного положения (Иванова и другие. , 2004; Асано и др., 2005). Это согласуется с результатами структурных исследований, показывающих, что С-концевой хвост SmpB занимает путь мРНК на ранней стадии трансляции транс , так что он конкурирует с 3′-удлинением мРНК (Kurita et al., 2010; Neubauer et al., 2012).
, 2004; Асано и др., 2005). Это согласуется с результатами структурных исследований, показывающих, что С-концевой хвост SmpB занимает путь мРНК на ранней стадии трансляции транс , так что он конкурирует с 3′-удлинением мРНК (Kurita et al., 2010; Neubauer et al., 2012).
Протеомные исследования показали, что трансляция транс- предпочтительно происходит в кодоне пролина, непосредственно предшествующем стоп-кодону (Hayes et al., 2002a, b). Asp-Pro, Glu-Pro, Pro-Pro, Ile-Pro и Val-Pro являются подходящими C-концевыми дипептидами для трансляции trans , что указывает на дополнительную важность предпоследнего остатка.Фактически, Asp-Pro и Pro-Pro необычно недостаточно представлены на С-конце в большинстве бактериальных белков. Из-за структурной нерегулярности пролина, имеющего вторичный амин вместо первичного, пептидил-Pro-тРНК Pro в A-сайте будет мешать доступу фактора высвобождения пептида (Janssen and Hayes, 2009), а не этому. комплекса Ala-tmRNA · SmpB · EF-Tu · GTP. Соответственно, ограниченные количества аминоацил-тРНК или фактора высвобождения индуцируют трансляцию транс , что указывает на конкуренцию трансляции транс с аминоацил-тРНК и фактором высвобождения за смысловые и несмысловые кодоны, соответственно, в остановившейся рибосоме (Иванова и др. al., 2004; Асано и др., 2005; Ли и др., 2007). Последовательные остатки пролина также влияют на перенос пептидила во время процесса элонгации, вызывая остановку трансляции, которая может быть устранена с помощью EF-P (Doerfel et al., 2013; Ude et al., 2013).
Соответственно, ограниченные количества аминоацил-тРНК или фактора высвобождения индуцируют трансляцию транс , что указывает на конкуренцию трансляции транс с аминоацил-тРНК и фактором высвобождения за смысловые и несмысловые кодоны, соответственно, в остановившейся рибосоме (Иванова и др. al., 2004; Асано и др., 2005; Ли и др., 2007). Последовательные остатки пролина также влияют на перенос пептидила во время процесса элонгации, вызывая остановку трансляции, которая может быть устранена с помощью EF-P (Doerfel et al., 2013; Ude et al., 2013).
Эти in vivo и in vitro исследования вместе уладили противоречие, показанное выше: в некоторых ситуациях трансляция может останавливаться даже в середине мРНК, и такая застопорившаяся рибосома может быть потенциальной мишенью для трансляции trans , хотя это по существу будет происходить только после расщепления мРНК вокруг A-сайта с помощью RelE или другой еще не идентифицированной рибонуклеазы с помощью 3’– 5′-экзорибонуклеазы РНКазы II.
Как описано выше, наиболее важная роль трансляции trans заключается в том, чтобы способствовать рециклированию застопорившихся рибосом в клетке. Считается, что трансляция Trans выполняет дополнительные функции в качестве систем контроля качества белка и мРНК.
Большинство продуктов трансляции trans будут нефункциональными, и, следовательно, их накопление может быть вредным для клетки.Чтобы избежать этой ситуации, tag-пептид и, в свою очередь, продукты трансляции trans быстро разлагаются в клетке цитоплазматическими АТФ-зависимыми протеазами (протеазы AAA + ), включая ClpXP, ClpAP, Lon и FtsH, а также периплазматическая протеаза Tsp (Prc; фиг. 4). ClpX или ClpA распознают C-концевую последовательность ALAA тега-пептида, чтобы разворачивать продукты трансляции trans АТФ-зависимым образом для деградации ее партнерской пептидазой ClpP (Gottesman et al. , 1998). Тег-пептид специфически связывается с белком SspB, повышая его сродство к ClpX, и, следовательно, считается, что ClpXP играет доминирующую роль в деградации продуктов трансляции транс-, по крайней мере, в β- и γ-протеобактериях (Flynn et al. al., 2001) и, возможно, у α-протеобактерий (Lessner et al., 2007). Lon участвует в деградации продуктов трансляции транс- в стрессовых условиях (Choy et al., 2007). FtsH прикрепляется к цитоплазматической стороне внутренней мембраны для разложения связанных с мембраной продуктов трансляции — (Herman et al., 1998). С-концевая последовательность ALAA tag-пептида, необходимая для ClpXP и ClpAP, является высококонсервативной среди бактерий, за исключением Mycoplasma , у которой tag-пептид заканчивается AFA вместо ALAA. Это может быть решено отсутствием ClpXP, ClpAP и Tsp в Mycoplasma (Gur and Sauer, 2008; Ge and Karzai, 2009).
, 1998). Тег-пептид специфически связывается с белком SspB, повышая его сродство к ClpX, и, следовательно, считается, что ClpXP играет доминирующую роль в деградации продуктов трансляции транс-, по крайней мере, в β- и γ-протеобактериях (Flynn et al. al., 2001) и, возможно, у α-протеобактерий (Lessner et al., 2007). Lon участвует в деградации продуктов трансляции транс- в стрессовых условиях (Choy et al., 2007). FtsH прикрепляется к цитоплазматической стороне внутренней мембраны для разложения связанных с мембраной продуктов трансляции — (Herman et al., 1998). С-концевая последовательность ALAA tag-пептида, необходимая для ClpXP и ClpAP, является высококонсервативной среди бактерий, за исключением Mycoplasma , у которой tag-пептид заканчивается AFA вместо ALAA. Это может быть решено отсутствием ClpXP, ClpAP и Tsp в Mycoplasma (Gur and Sauer, 2008; Ge and Karzai, 2009).
РИСУНОК 4. Пути спасения рибосом вместе с путями сворачивания и деградации в клетке E. coli . Пути сворачивания и разложения показаны синим и красным соответственно.
coli . Пути сворачивания и разложения показаны синим и красным соответственно.
В то время как трансляция транс и индуцируется расщеплением мРНК в остановившейся рибосоме, как описано выше, трансляция транс также способствует дальнейшей деградации безостановочной мРНК (Yamamoto et al., 2003). Trans -трансляция д. Обнажать 3′-конец нон-стоп мРНК, секвестрированной остановившейся рибосомой, облегчая доступ 3’– 5′-экзорибонуклеазы для деградации нон-стоп мРНК. Это должно быть большим преимуществом для клетки, учитывая, что остановка рибосомы будет повторяться до тех пор, пока безостановочная мРНК не будет деградировать, даже если остановившаяся рибосома на 3′-конце полисомы будет спасена с помощью трансляции транс и .РНКаза R является вероятным кандидатом на роль такой экзорибонуклеазы (Oussenko et al., 2005; Mehta et al., 2006; Richards et al., 2006; Ge et al., 2011). E. coli РНКаза R образует комплекс с тмРНК и SmpB (Karzai and Sauer, 2001) посредством прямого взаимодействия с SmpB (Liang and Deutscher, 2010). Он индуцируется в стрессовых условиях у E. coli (Chen and Deutscher, 2005) и участвует в регулируемой клеточным циклом деградации тмРНК у Caulobacter crescentus (Hong et al., 2005). E. coli РНКаза R ацетилируется в экспоненциальной фазе, что приводит к экспоненциальной фазо-специфической деградации за счет более прочного связывания с тмРНК · SmpB (Liang et al., 2011).
Он индуцируется в стрессовых условиях у E. coli (Chen and Deutscher, 2005) и участвует в регулируемой клеточным циклом деградации тмРНК у Caulobacter crescentus (Hong et al., 2005). E. coli РНКаза R ацетилируется в экспоненциальной фазе, что приводит к экспоненциальной фазо-специфической деградации за счет более прочного связывания с тмРНК · SmpB (Liang et al., 2011).
Физиологическое значение
Trans -Translation Очевидная универсальность системы трансляции транс среди бактерий предполагает некоторое биологическое значение этой системы. Действительно, он необходим для некоторых бактерий, включая Neisseria gonorrhoeae (Huang et al., 2000), Mycoplasma genitalium (Hutchison et al., 1999), Haemophilus influenzae (Akerley et al., 2002), Helicobacter pylori (Thibonnier et al., 2008) и Shigella flexneri ( et al., 2013a), а его истощение вызывает широкий спектр расстройств. Поскольку ее отсутствие вызывает авирулентность некоторых инфекционных бактерий, система трансляции trans была сосредоточена как эффективная мишень для антибиотиков (Shi et al. , 2011; Ramadoss et al., 2013б).
, 2011; Ramadoss et al., 2013б).
Многие из этих дефектных фенотипов вызваны дефектом реакции трансляции trans , а не деградацией продуктов трансляции trans (Keiler, 2008). Это говорит о том, что рециклинг рибосом важнее для клетки, чем предотвращение накопления нефункциональных белков. При недостатке аминокислот поступление аминокислот из продуктов трансляции транс- должно стать важным для синтеза нового белка (Pedersen et al., 2003; Ли и др., 2008).
Транс-трансляция часто используется для регуляции экспрессии генов. В E. coli опосредованная тмРНК трансляция нацелена на мРНК для LacI, репрессора лактозного оперона, для ускорения его деградации при истощении глюкозы, что приводит к дерепрессии оперона lac (Abo et al., 2000). В Bacillus subtilis , трансляция транс- происходит вокруг последовательности реагирующего на катаболизм элемента ( cre ), сайта связывания репрессорного белка, контролирующего белок А катаболита (CcpA), в кодирующей области нескольких мРНК, включая мРНК TreP для трегалозофосфорилаза (Fujihara et al. , 2002). Связывание CcpA с последовательностью cre д. Индуцировать транскрипционный барьер для продукции укороченной мРНК (Ujiie et al., 2009). В C. crescentus клеточный цикл (Keiler and Shapiro, 2003a) и инициация репликации ДНК (Keiler and Shapiro, 2003b; Hong et al., 2007) контролируются трансляцией trans -трансляции.
, 2002). Связывание CcpA с последовательностью cre д. Индуцировать транскрипционный барьер для продукции укороченной мРНК (Ujiie et al., 2009). В C. crescentus клеточный цикл (Keiler and Shapiro, 2003a) и инициация репликации ДНК (Keiler and Shapiro, 2003b; Hong et al., 2007) контролируются трансляцией trans -трансляции.
Накапливаются доказательства повышенной важности тмРНК в стрессовых условиях, таких как высокая или низкая температура (Oh and Apirion, 1991; Muto et al., 2000; Shin and Price, 2007), недостаток питательных веществ (Oh and Apirion, 1991; Okan et al., 2006; Abe et al., 2008), обработка этанолом (Muto et al., 2000), обработка кадмием (Muto et al., 2000) и воздействие кислоты (Thibonnier et al., 2008). Стрессы могут увеличивать частоту аберрантной трансляции в клетках, что может быть устранено трансляцией транс . Соответственно, общее количество продуктов трансляции транс- увеличивается в стрессовых условиях (Fujihara et al.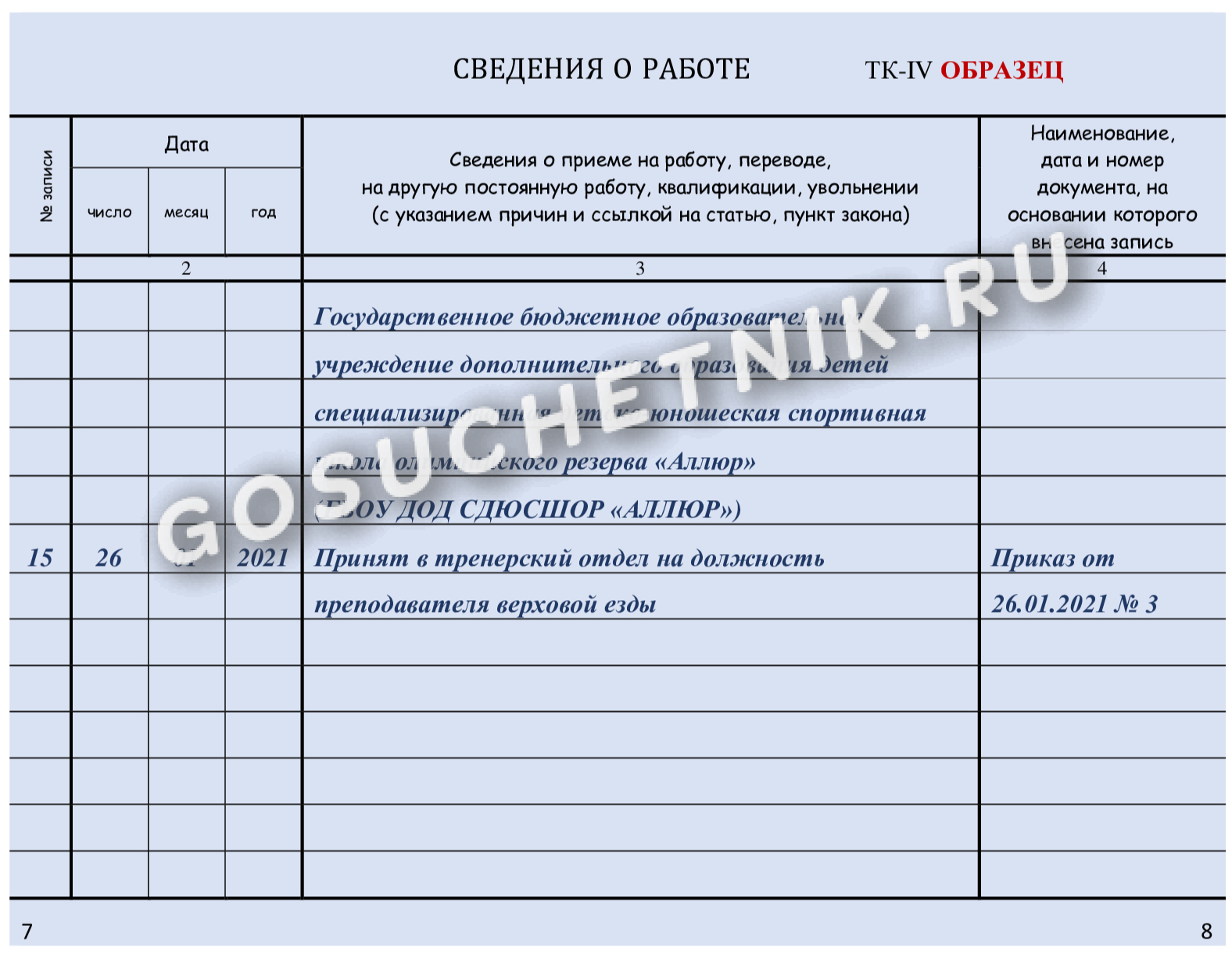 , 2002). Возможно, в ответ на повышенную потребность в системе трансляции trans , внутриклеточный уровень тмРНК или SmpB увеличивается с увеличением стресса у некоторых бактерий (Muto et al., 2000; Palecková et al., 2007; Rezzonico et al., 2007).
, 2002). Возможно, в ответ на повышенную потребность в системе трансляции trans , внутриклеточный уровень тмРНК или SmpB увеличивается с увеличением стресса у некоторых бактерий (Muto et al., 2000; Palecková et al., 2007; Rezzonico et al., 2007).
Система трансляции trans иногда регулирует другие системы реакции на стресс, возможно, посредством экспрессии глобального регулятора. Например, истощение тмРНК вызывает реакцию теплового шока у E. coli (Munavar et al., 2005). Уровень экспрессии сигма-фактора RpoS (сигма S), который контролирует экспрессию ряда генов, участвующих в общем стрессовом ответе, положительно контролируется трансляцией trans в E.coli (Ранкет и Готтесман, 2007). Также предполагается участие трансляции во внеклеточном пути стресс-ответа посредством др. Сигма-фактора, RpoE (сигма E) (Ono et al., 2009). Другие связанные со стрессом белки, включая молекулярный шаперон DnaK, регулируются трансляцией транс- у стрептомицетов (Barends et al. , 2010). Интересно, что экспрессия ArfA, альтернативной системы спасения рибосом (описанной в следующем подразделе), регулируется трансляцией транс (Chadani et al., 2011а; Garza-Sánchez et al., 2011).
, 2010). Интересно, что экспрессия ArfA, альтернативной системы спасения рибосом (описанной в следующем подразделе), регулируется трансляцией транс (Chadani et al., 2011а; Garza-Sánchez et al., 2011).
Эволюционные аспекты
Trans — Перевод Хотя это не является важным для жизнеспособности большинства бактерий, тмРНК присутствует повсеместно в бактериальном царстве и в некоторых пластидах или митохондриях некоторых протистов. ТРНК-подобная вторичная структура TLD, а также несколько консенсусных последовательностей, специфичных для тРНК, являются высококонсервативными, за исключением деформированной структуры D-плеча, которая имеет обширное взаимодействие с SmpB. Кроме того, положение третьей пары оснований акцепторного стержня аминокислоты полностью законсервировано как G-U, которое служит мощным детерминантом идентичности для распознавания аланил-тРНК синтетазой (AlaRS).Аланин не может быть абсолютной предпосылкой для трансляции trans , поскольку аминокислота аминоацилирована в тмРНК, как показано Nameki et al. (1999a). Однако AlaRS может быть наиболее предпочтительной аминоацил-тРНК синтетазой для тмРНК, учитывая уникальный способ распознавания AlaRS, который в значительной степени зависит от акцепторной ножки, а не от антикодона. Подобная тРНК структура также будет иметь значение для распознавания EF-Tu и РНКазой P, а также для связывания с рибосомами. В отличие от высокой степени сохранности TLD, в области, богатой псевдоузлами, есть вариации (Nameki et al., 1999b; Уильямс, 2002). Пластидная тмРНК имеет меньше структур псевдоузлов или не имеет их (Gueneau de Novoa and Williams, 2004). Действительно, по крайней мере, последние три из четырех псевдоузлов тмРНК E. coli необязательны для трансляции in vitro (Nameki et al., 2000), хотя они участвуют в правильном сворачивании и процессинге тмРНК (Wower et al., 2004). TLD и богатая псевдоузлами область связаны длинной вырожденной спиралью, которая выступает из TLD в направлении, соответствующем направлению длинного вариабельного плеча тРНК класса II (рисунок 1B; Bessho et al.
(1999a). Однако AlaRS может быть наиболее предпочтительной аминоацил-тРНК синтетазой для тмРНК, учитывая уникальный способ распознавания AlaRS, который в значительной степени зависит от акцепторной ножки, а не от антикодона. Подобная тРНК структура также будет иметь значение для распознавания EF-Tu и РНКазой P, а также для связывания с рибосомами. В отличие от высокой степени сохранности TLD, в области, богатой псевдоузлами, есть вариации (Nameki et al., 1999b; Уильямс, 2002). Пластидная тмРНК имеет меньше структур псевдоузлов или не имеет их (Gueneau de Novoa and Williams, 2004). Действительно, по крайней мере, последние три из четырех псевдоузлов тмРНК E. coli необязательны для трансляции in vitro (Nameki et al., 2000), хотя они участвуют в правильном сворачивании и процессинге тмРНК (Wower et al., 2004). TLD и богатая псевдоузлами область связаны длинной вырожденной спиралью, которая выступает из TLD в направлении, соответствующем направлению длинного вариабельного плеча тРНК класса II (рисунок 1B; Bessho et al. , 2007). Это направление должно сохраняться в рамках ограничений тРНК-подобного динамического поведения тмРНК в ограниченном пространстве рибосомы, хотя последовательность соединительной спирали менее консервативна.
, 2007). Это направление должно сохраняться в рамках ограничений тРНК-подобного динамического поведения тмРНК в ограниченном пространстве рибосомы, хотя последовательность соединительной спирали менее консервативна.
В некоторых линиях α-протеобактерий, β-протеобактерий, цианобактерий и митохондрий низших эукариот тмРНК разделена на две части, 5′-кодирующая часть обычно включает только два псевдоязыка (PK1 и PK2) с областью, кодирующей тег. между ними и акцепторной частью 3′-аминокислоты, и две части соединяются вместе путем спаривания оснований с образованием тРНК-подобной структуры, аналогичной структуре цельной тмРНК (рисунок 1A; Keiler et al., 2000; Уильямс, 2002; Шаркади и Уильямс, 2004 г.). Ген двухкомпонентной тмРНК циклически пермутирован (Keiler et al., 2000; Williams, 2002; Mao et al., 2009), и пермутированный предшественник может быть преобразован в зрелую двухкомпонентную тмРНК, вероятно, с помощью РНКазы. P и tRNase Z. Сходная стратегия процессинга была обнаружена в гене циркулярно пермутированной тРНК у некоторых примитивных эукариот или архебактерий (Soma et al. , 2007). Было показано, что состоящая из двух частей тмРНК в C. crescentus , принадлежащая α-протеобактериям, действительно функционирует при трансляции trans (Keiler et al., 2000). Цельная или двухкомпонентная тмРНК присутствует в митохондриальном геноме некоторых групп протистов (jakobids; Jacob et al., 2004). У них отсутствует последовательность, кодирующая метку, а также псевдоузлы, что противоречит их способности к бактериальному типу трансляции транс .
, 2007). Было показано, что состоящая из двух частей тмРНК в C. crescentus , принадлежащая α-протеобактериям, действительно функционирует при трансляции trans (Keiler et al., 2000). Цельная или двухкомпонентная тмРНК присутствует в митохондриальном геноме некоторых групп протистов (jakobids; Jacob et al., 2004). У них отсутствует последовательность, кодирующая метку, а также псевдоузлы, что противоречит их способности к бактериальному типу трансляции транс .
SmpB вместе с тмРНК повсеместно присутствует в бактериях. Пластидная тмРНК кодируется пластидным геномом, а пластидная SmpB кодируется ядерным геномом и импортируется из цитоплазмы (Jacob et al., 2005). До сих пор не было сообщений о митохондриальном SmpB. И тмРНК, и SmpB должны были потребоваться при рождении трансляции транс-. Ген тмРНК мог быть образован в результате встраивания чего-либо в ген тРНК Ala . Напротив, никто не может предвидеть происхождение SmpB из-за отсутствия его гомолога.
Разнообразие систем спасения застопорившихся переводов
Как описано выше, трансляция trans нацелена на различные виды приостановки трансляции из-за редкого кодона, неэффективного кодона терминации или запрограммированной задерживающей последовательности, но после расщепления мРНК.У бактериальной клетки есть альтернативные механизмы для спасения застопорившейся рибосомы (рис. 4; Himeno, 2010).
Пептидил-тРНК гидролаза (Pth) обладает активностью по гидролизу связи между тРНК и растущим полипептидом пептидил-тРНК после того, как он отпадет от рибосомы. Падение усиливается только за счет RRF, RRF вместе с RF3 (Heurgué-Hamard et al., 1998; Gong et al., 2007) или RRF, IF3 и EF-G (Singh et al., 2008). Первоначально предполагалось, что выпадение происходит в более ранних циклах удлинения.Это кажется разумным, учитывая, что более длинная растущая полипептидная цепь может предотвратить высвобождение пептидил-тРНК из пептидного канала транслирующей рибосомы. Однако было показано, что спад эффективно происходит на 3′-конце нон-стоп мРНК в отсутствие тмРНК (Kuroha et al., 2009). Сверхэкспрессия тмРНК подавляет термочувствительный фенотип Pth (Singh and Varshney, 2004), предполагая, что Pth способствует не только гидролизу выпавшей пептидил-тРНК, но также и спасению застопорившейся рибосомы, или предполагая, что трансляция транс может заменитель спонтанного или стимулирующего фактор спада и последующего гидролиза пептидил-тРНК с помощью Pth.
Однако было показано, что спад эффективно происходит на 3′-конце нон-стоп мРНК в отсутствие тмРНК (Kuroha et al., 2009). Сверхэкспрессия тмРНК подавляет термочувствительный фенотип Pth (Singh and Varshney, 2004), предполагая, что Pth способствует не только гидролизу выпавшей пептидил-тРНК, но также и спасению застопорившейся рибосомы, или предполагая, что трансляция транс может заменитель спонтанного или стимулирующего фактор спада и последующего гидролиза пептидил-тРНК с помощью Pth.
Недавно было обнаружено, что два белка, ArfA (YhdL) и YaeJ (ArfB), способствуют восстановлению застопорившейся рибосомы. Одиночный нокаут либо E. coli, ArfA, либо тмРНК жизнеспособен, тогда как двойной нокаут является летальным, что объясняет, почему тмРНК не важна для многих бактерий (Chadani et al., 2010). Активность ArfA по спасению рибосом первоначально была продемонстрирована с использованием неочищенного экстракта E. coli (Chadani et al., 2010). Однако один только ArfA не обладает активностью по гидролизу пептидил-тРНК в P-сайте, возможно, из-за отсутствия типичного каталитического мотива GGQ, и для этого требуется помощь RF-2 (Chadani et al. , 2012; Симидзу, 2012). RF-2 обычно действует как кодон-зависимый фактор высвобождения UAA или UGA, в то время как он служит как независимый от стоп-кодонов фактор высвобождения в присутствии ArfA. Интересно, что трансляция белка ArfA останавливается около 3′-конца его мРНК из-за расщепления РНКазой III, и, следовательно, ArfA обычно расщепляется через систему трансляции trans , и только когда клеточная активность трансляции trans становится уменьшенным, является усеченным на С-конце, но активный ArfA синтезируется посредством спонтанного падения или ArfA-опосредованного высвобождения растущего полипептида (Garza-Sánchez et al., 2011; Chadani et al., 2011a). Таким образом, ArfA-опосредованная система спасения рибосом считается резервной системой для трансляции транс . YaeJ также спасает рибосомы, застрявшие на 3′-конце нон-стоп мРНК in vitro, (Handa et al., 2011) и in vivo, (Chadani et al., 2011b). Двойной нокаут E. coli, ArfA и тмРНК является летальным, как описано выше, тогда как сверхэкспрессия YaeJ делает его жизнеспособным (Chadani et al.
, 2012; Симидзу, 2012). RF-2 обычно действует как кодон-зависимый фактор высвобождения UAA или UGA, в то время как он служит как независимый от стоп-кодонов фактор высвобождения в присутствии ArfA. Интересно, что трансляция белка ArfA останавливается около 3′-конца его мРНК из-за расщепления РНКазой III, и, следовательно, ArfA обычно расщепляется через систему трансляции trans , и только когда клеточная активность трансляции trans становится уменьшенным, является усеченным на С-конце, но активный ArfA синтезируется посредством спонтанного падения или ArfA-опосредованного высвобождения растущего полипептида (Garza-Sánchez et al., 2011; Chadani et al., 2011a). Таким образом, ArfA-опосредованная система спасения рибосом считается резервной системой для трансляции транс . YaeJ также спасает рибосомы, застрявшие на 3′-конце нон-стоп мРНК in vitro, (Handa et al., 2011) и in vivo, (Chadani et al., 2011b). Двойной нокаут E. coli, ArfA и тмРНК является летальным, как описано выше, тогда как сверхэкспрессия YaeJ делает его жизнеспособным (Chadani et al. , 2011a). В отличие от ArfA, YaeJ сам по себе обладает активностью по гидролизу пептидил-тРНК в P-сайте застопорившейся рибосомы, как и ожидалось, исходя из последовательности и структуры, сходной с таковыми из каталитического домена фактора высвобождения бактериального класса I, имеющего мотив GGQ.YaeJ, вероятно, будет действовать как фактор высвобождения стоп-кодон-независимой пептидной цепи, поскольку в нем отсутствует домен распознавания стоп-кодонов, и вместо этого он заменен С-концевым расширением, богатым основными остатками, которое может быть неструктурированным в растворе (Handa et al. ., 2010). В кристаллической структуре E. coli YaeJ в комплексе с остановившейся рибосомой из T. thermophilus C-концевое удлинение YaeJ, как и SmpB, связывается вдоль пути мРНК застопорившейся рибосомы, идущей вниз по течению. мРНК-туннель с α-спиральной структурой (Gagnon et al., 2012). ArfA, как и Ala-tmRNA · SmpB · EF-Tu (GTP), не способствует длинному 3′-удлинению мРНК из области декодирования при входе в остановившуюся рибосому, тогда как YaeJ менее чувствителен (Shimizu, 2012).
, 2011a). В отличие от ArfA, YaeJ сам по себе обладает активностью по гидролизу пептидил-тРНК в P-сайте застопорившейся рибосомы, как и ожидалось, исходя из последовательности и структуры, сходной с таковыми из каталитического домена фактора высвобождения бактериального класса I, имеющего мотив GGQ.YaeJ, вероятно, будет действовать как фактор высвобождения стоп-кодон-независимой пептидной цепи, поскольку в нем отсутствует домен распознавания стоп-кодонов, и вместо этого он заменен С-концевым расширением, богатым основными остатками, которое может быть неструктурированным в растворе (Handa et al. ., 2010). В кристаллической структуре E. coli YaeJ в комплексе с остановившейся рибосомой из T. thermophilus C-концевое удлинение YaeJ, как и SmpB, связывается вдоль пути мРНК застопорившейся рибосомы, идущей вниз по течению. мРНК-туннель с α-спиральной структурой (Gagnon et al., 2012). ArfA, как и Ala-tmRNA · SmpB · EF-Tu (GTP), не способствует длинному 3′-удлинению мРНК из области декодирования при входе в остановившуюся рибосому, тогда как YaeJ менее чувствителен (Shimizu, 2012). Таким образом, бактериальные клетки снабжены множеством систем, чтобы справиться с остановленной трансляцией, и поэтому они часто остаются жизнеспособными, даже когда они теряют систему трансляции транс . Судя по фенотипам клеток с истощенным фактором, система трансляции транс должна быть первичной системой спасения рибосом.
Таким образом, бактериальные клетки снабжены множеством систем, чтобы справиться с остановленной трансляцией, и поэтому они часто остаются жизнеспособными, даже когда они теряют систему трансляции транс . Судя по фенотипам клеток с истощенным фактором, система трансляции транс должна быть первичной системой спасения рибосом.
Есть несколько сообщений о стресс-специфических системах спасения рибосом. Было показано, что белок теплового шока HSP15 связывается с диссоциированной субъединицей 50S с растущим белком (Korber et al., 2000). При воздействии высокой температуры часть транслирующихся рибосом может преждевременно диссоциировать на субъединицы, хотя пептидил-тРНК остается связанной с диссоциированной субъединицей 50S, если только формирующийся пептид не является коротким. В этой 50S-субъединице HSP15 фиксирует пептидил-тРНК в P-сайте, чтобы сделать A-сайт свободным, предположительно для входа фактора высвобождения пептида (Jiang et al., 2009). Высокая внутриклеточная концентрация ионов магния или низкая температура вызывают остановку трансляции после дефектной транслокации. Он также способствует высвобождению GTPase, EF4 (LepA), которая обычно хранится в клеточной мембране, в цитоплазму, чтобы спасти остановку трансляции за счет обратной транслокации (Pech et al., 2011).
Он также способствует высвобождению GTPase, EF4 (LepA), которая обычно хранится в клеточной мембране, в цитоплазму, чтобы спасти остановку трансляции за счет обратной транслокации (Pech et al., 2011).
Трансляция часто запрограммированным образом останавливается на определенном сайте мРНК. Как и в случае экспрессии ArfA, описанной выше (Chadani et al., 2011a; Garza-Sánchez et al., 2011), остановка трансляции иногда используется для подавления экспрессии гена с помощью трансляции транс и . С другой стороны, застопорившаяся рибосома часто препятствует доступу средств спасения, чтобы сохранить остановку трансляции для регуляции экспрессии генов. Оперон триптофаназы E. coli ( tna ) индуцируется триптофаном посредством остановки трансляции лидерного пептида (TnaC) путем ингибирования гидролиза пептидил-тРНК Pro с помощью RF2 (Yanofsky, 2007). Эта застопорившаяся рибосома не восстанавливается трансляцией trans в присутствии триптофана, хотя она медленно восстанавливается RRF и RF3, что приводит к падению (Gong et al. , 2007). Рибосома также останавливается на внутреннем пролиновом кодоне мРНК E. coli secM , которая активирует трансляцию нижестоящей последовательности, кодирующей SecA, предположительно за счет разрушения вторичной структуры, которая секвестрирует сайт связывания рибосомы (Muto et al. ., 2006). Эта остановка трансляции вызвана неэффективным переносом пептидилом Pro-тРНК Pro в A-сайте на растущую пептидил-тРНК в P-сайте, что ингибирует проникновение Ala-тмРНК в A-сайт и A- сайт-специфическое расщепление мРНК (Garza-Sánchez et al., 2006). Трансляция мРНК B. subtilis yidC регулируется посредством остановки трансляции во множестве сайтов на вышестоящей мРНК mifM (Chiba et al., 2009; Chiba and Ito, 2012). Пуромицин менее реагирует на этот арест трансляции, что позволяет предположить, что механизмы спасения рибосом, включая Ala-tmRNA · SmpB · EF-Tu (GTP), также менее доступны для A-сайта этой остановившейся рибосомы. Последовательные кодоны пролина вызывают остановку трансляции из-за неэффективного переноса пептидила между пептидил- (Pro) n-тРНК в P-сайте и Pro-тРНК в A-сайте (Doerfel et al.
, 2007). Рибосома также останавливается на внутреннем пролиновом кодоне мРНК E. coli secM , которая активирует трансляцию нижестоящей последовательности, кодирующей SecA, предположительно за счет разрушения вторичной структуры, которая секвестрирует сайт связывания рибосомы (Muto et al. ., 2006). Эта остановка трансляции вызвана неэффективным переносом пептидилом Pro-тРНК Pro в A-сайте на растущую пептидил-тРНК в P-сайте, что ингибирует проникновение Ala-тмРНК в A-сайт и A- сайт-специфическое расщепление мРНК (Garza-Sánchez et al., 2006). Трансляция мРНК B. subtilis yidC регулируется посредством остановки трансляции во множестве сайтов на вышестоящей мРНК mifM (Chiba et al., 2009; Chiba and Ito, 2012). Пуромицин менее реагирует на этот арест трансляции, что позволяет предположить, что механизмы спасения рибосом, включая Ala-tmRNA · SmpB · EF-Tu (GTP), также менее доступны для A-сайта этой остановившейся рибосомы. Последовательные кодоны пролина вызывают остановку трансляции из-за неэффективного переноса пептидила между пептидил- (Pro) n-тРНК в P-сайте и Pro-тРНК в A-сайте (Doerfel et al. , 2013; Удэ и др., 2013). В этом случае A-сайт занят Pro-tRNA Pro , и, в свою очередь, Ala-tmRNA · SmpB · EF-Tu (GTP), ArfA или YaeJ не сможет получить доступ к этой остановившейся рибосоме. Вместо этого центр пептидилтрансферазы модулируется связыванием EF-P с областью между P-сайтом и E-сайтом, чтобы возобновить перенос пептидила (Blaha et al., 2009). Блокирующие последовательности Pro – Pro – Pro и Gly – Pro – Pro, которые могут быть восстановлены с помощью EF-P, часто обнаруживаются в бактериальных генах, и они могут быть запрограммированы для регуляции экспрессии генов.
, 2013; Удэ и др., 2013). В этом случае A-сайт занят Pro-tRNA Pro , и, в свою очередь, Ala-tmRNA · SmpB · EF-Tu (GTP), ArfA или YaeJ не сможет получить доступ к этой остановившейся рибосоме. Вместо этого центр пептидилтрансферазы модулируется связыванием EF-P с областью между P-сайтом и E-сайтом, чтобы возобновить перенос пептидила (Blaha et al., 2009). Блокирующие последовательности Pro – Pro – Pro и Gly – Pro – Pro, которые могут быть восстановлены с помощью EF-P, часто обнаруживаются в бактериальных генах, и они могут быть запрограммированы для регуляции экспрессии генов.
Pth необходим для бактерий и широко распространен среди других доменов. В то время как система трансляции транс- универсально существует у бактерий, YaeJ распространяется среди грамотрицательных бактерий, а ArfA имеет более ограниченное распространение среди энтеробактерий. EF-P консервативен среди бактерий, а его гомолог (a / eIF5A) повсеместно присутствует у архей и эукариот. EF4 универсально консервативен среди бактерий. Ни тмРНК, ни SmpB не присутствуют в цитоплазме эукариот, где комплекс Dom34p (Pelota) и GTP-связывающего белка Hbs1 способствует диссоциации субъединицы застопорившейся рибосомы и падению пептидил-тРНК (Shoemaker et al., 2010) совместно с АТФазой, ABCE1 (Pisareva et al., 2011). Комплекс Dom34p · Hbs1 структурно подобен комплексу eRF1 · eRF3 или комплексу аминоацил-тРНК · EF-Tu (Chen et al., 2010), хотя мотив GGQ отсутствует в Dom34, и предполагается, что гидролиз пептидил-тРНК вызывает катализироваться Pth после падения. В митохондриях два белковых фактора, частично похожие на фактор высвобождения бактериального класса I, ICT1 (гомолог YaeJ) и C12orf65, оба лишены домена распознавания стоп-кодона, но сохраняют каталитический мотив GGQ, участвуют в спасении рибосом (Handa et al., 2010; Richter et al., 2010; Когуре и др., 2012, 2014). ICT1 (YaeJ), но не C12orf65, имеет вставку α-спирали в домен GGQ, и, таким образом, ICT1 менее похож на фактор высвобождения класса I. C12orf65 был обнаружен у очень ограниченного числа бактерий. В совокупности было обнаружено, что различные виды гомологов фактора высвобождения, YaeJ, ICT1, C12orf65, ArfA / RF2, Dom34p (Pelota) и Hbs1, участвуют в спасении рибосом. Система трансляции trans уникальна тем, что в ней используется малая РНК и что она предотвращает накопление нефункциональных белков усеченной мРНК в клетке.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарны всем, кто принимал участие в работе. Эта работа была поддержана грантом на научные исследования от Министерства образования, науки, спорта и культуры Японии для Хьюта Химено, грантами на научные исследования (B) и (C) от Японского общества. за содействие науке Акире Муто и субсидии для молодых ученых от Японского общества содействия науке Дайсуке Курите.
Список литературы
Abe, T., Sakaki, K., Fujihara, A., Ujiie, H., Ushida, C., Himeno, H., et al. (2008). tmRNA-зависимая трансляция trans необходима для споруляции в Bacillus subtilis . Мол. Microbiol. 69, 1491–1498. DOI: 10.1111 / j.1365-2958.2008.06381.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Або, Т., Инада, Т., Огава, К., и Айба, Х. (2000). SsrA-опосредованное мечение и протеолиз LacI и его роль в регуляции lac-оперона. EMBO J. 19, 3762–3769. DOI: 10.1093 / emboj / 19.14.3762
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Або, Т., Уэда, К., Сунохара, Т., Огава, К., и Айба, Х. (2002). SsrA-опосредованная маркировка белков в присутствии ошибочно кодирующих лекарств и ее физиологическая роль в Escherichia coli . Гены Клеток 7, 629–638. DOI: 10.1046 / j.1365-2443.2002.00549.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Акерли, Б.Дж., Рубин, Э. Дж., Новик, В. Л., Амайя, К., Джадсон, Н., и Мекаланос, Дж. Дж. (2002). Анализ в масштабе генома для идентификации генов, необходимых для роста или выживания Haemophilus influenzae . Proc. Natl. Акад. Sci. США 99, 966–971. DOI: 10.1073 / pnas.012602299
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Асано К., Курита Д., Такада К., Конно Т., Муто А. и Химено Х. (2005). Конкуренция между переводом trans и прекращением или продлением перевода. Nucleic Acids Res. 33, 5544–5552. DOI: 10.1093 / nar / gki871
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Барендс, С., Карзай, А. В., Зауэр, Р. Т., Вовер, Дж., И Крааль, Б. (2001). Одновременное функциональное связывание SmpB и EF-Tu-GTP с аланиловым акцепторным плечом тмРНК. J. Mol. Биол. 314, 9–21. DOI: 10.1006 / jmbi.2001.5114
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Барендс, С., Вовер, Дж.и Краал Б. (2000). Кинетические параметры связывания тмРНК с аланил-тРНК синтетазой и фактором элонгации Tu из Escherichia coli . Биохимия 39, 2652–2658. DOI: 10.1021 / bi992439d
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Barends, S., Zehl, M., Bialek, S., de Waal, E., Traag, B.A., Willemse, J., et al. (2010). РНК-мессенджер контролирует трансляцию белков клеточного цикла и стресса в Streptomyces . EMBO Rep. 11, 119–125. DOI: 10.1038 / embor.2009.255
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Бесшо, Ю., Шибата, Р., Секин, С., Мураяма, К., Хигасидзима, К., Хори-Такемото, К., и др. (2007). Структурная основа функциональной мимикрии тРНК с длинным переменным плечом с помощью РНК-мессенджера. Proc. Natl. Акад. Sci. США 104, 8293–8298. DOI: 10.1073 / pnas.0700402104
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Блаха, Г., Стэнли, Р. Э., и Стейтц, Т. А. (2009). EF-P необходим для быстрого синтеза белков, содержащих последовательные остатки пролина. Science 325, 966–970. DOI: 10.1126 / science.1175800
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Каменарес Д., Дулебон Д. П., Светланов А. и Карзай А. В. (2013). Для активной и точной трансляции trans необходимы различные детерминанты в C-концевом хвосте белка SmpB и мРНК-подобном домене транспортной информационной РНК (тмРНК). J. Biol. Chem. 288, 30527–30542. DOI: 10.1074 / jbc.M113.503896
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чадани Ю., Ито К., Куцукаке К. и Або Т. (2012). ArfA привлекает фактор высвобождения 2 для восстановления застрявших рибосом путем гидролиза пептидил-тРНК в Escherichia coli . Мол. Microbiol. 86, 37–50. DOI: 10.1111 / j.1365-2958.2012.08190.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чадани, Ю., Мацумото, Э., Асо, Х., Вада, Т., Куцукаке, К., Сутоу, С., и др. (2011a). транс -опосредованная трансляцией жесткая регуляция экспрессии альтернативного фактора восстановления рибосом ArfA в Escherichia coli . Genes Genet. Syst. 86, 151–163. DOI: 10.1266 / ggs.86.151
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чадани, Ю., Оно, К., Куцукаке, К., и Або, Т. (2011b). Escherichia coli YaeJ белок опосредует новый путь восстановления рибосом, отличный от путей, опосредованных SsrA и ArfA. Мол. Microbiol. 80, 772–785. DOI: 10.1111 / j.1365-2958.2011.07607.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чадани Ю., Оно, К., Одзава, С., Такахаши, Ю., Такаи, К., Нанамия, Х., и др. (2010). Спасение рибосом с помощью Escherichia coli ArfA (YhdL) в отсутствие системы трансляции транс . Мол. Microbiol. 80, 772–775. DOI: 10.1111 / j.1365-2958.2011.07607.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чен, Л., Мюльрад, Д., Хаурылюк, В., Ченг, З., Лим, М. К., Шип, В. и др. (2010). Структура комплекса Dom34-Hbs1 и последствия для непрекращающегося распада. Нат. Struct. Мол. Биол. 17, 1233–1240. DOI: 10.1038 / nsmb.1922
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ченг, К., Иванова, Н., Шерес, С. Х., Павлов, М. Ю., Каразо, Дж. М., Хеберт, Х. и др. (2010). Комплекс тмРНК.SmpB имитирует нативные аминоацил-тРНК в сайте А застопорившихся рибосом . J. Struct.Биол. 169, 342–348. DOI: 10.1016 / j.jsb.2009.10.015
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кольер Дж., Бине Э. и Булок П. (2002). Конкуренция между тегированием SsrA и терминацией трансляции по слабым стоп-кодонам в Escherichia coli . Мол. Microbiol. 45, 745–754. DOI: 10.1046 / j.1365-2958.2002.03045.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Doerfel, L. K., Wohlgemuth, I., Кот, К., Песке, Ф., Урлауб, Х., Роднина, М. В. (2013). EF-P необходим для быстрого синтеза белков, содержащих последовательные остатки пролина. Наука 339, 85–88. DOI: 10.1126 / science.1229017
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Донг Г., Новаковски Дж. И Хоффман Д. В. (2002). Структура малого белка B: белковый компонент системы тмРНК-SmpB для спасения рибосом. EMBO J. 21, 1845–1854. DOI: 10,1093 / emboj / 21.7,1845
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Фельден Б., Ханава К., Аткинс Дж. Ф., Химено Х., Муто А., Гестеланд Р. Ф. и др. (1998). Наличие и расположение модифицированных нуклеотидов в тмРНК E. coli . Структурная мимикрия с акцепторными ветвями тРНК. EMBO J. 17, 3188–3196. DOI: 10.1093 / emboj / 17.11.3188
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Фельден, Б., Химено, Х., Муто, А., Маккатчеон, Дж.П., Аткинс, Дж. Ф., и Гестеланд, Р. Ф. (1997). Исследование структуры РНК Escherichia coli 10Sa (тмРНК). РНК 3, 89–103.
Pubmed Аннотация | Pubmed Полный текст
Фен, С., Чен, Ю., Камада, К., Ван, Х., Тан, К., Ван, М., и др. (2013). Структура YoeB-рибосомы: каноническая РНКаза, которой необходима рибосома для ее специфической активности. Nucleic Acids Res. 41, 9549–9556. DOI: 10.1093 / nar / gkt742
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Флинн, Дж.М., Левченко И., Зайдель М., Викнер С. Х., Зауэр Р. Т. и Бейкер Т. А. (2001). Перекрывающиеся детерминанты распознавания в теге деградации ssrA позволяют модулировать протеолиз. Proc. Natl. Акад. Sci. США 98, 10584–10589. DOI: 10.1073 / pnas.1
298Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Fu, J., Hashem, Y., Wower, I., Lei, J., Liao, H.Y., Zwieb, C., et al. (2010). Визуализация РНК-мессенджера по мере возобновления трансляции рибосомы. EMBO J. 29, 3819–3825. DOI: 10.1038 / emboj.2010.255
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Fujihara, A., Tomatsu, H., Inagaki, S., Tadaki, T., Ushida, C., Himeno, H., et al. (2002). Обнаружение тмРНК-опосредованных продуктов трансляции trans в Bacillus subtilis . Гены Клеток 7, 343–350. DOI: 10.1046 / j.1365-2443.2002.00523.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ганьон, М.Г., Ситараман, С. В., Балкли, Д., Стейтц, Т. А. (2012). Структурная основа спасения застопорившихся рибосом: структура YaeJ, связанная с рибосомой. Наука 335, 1370–1372. DOI: 10.1126 / science.1217443
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гарса-Санчес, Ф., Янссен, Б. Д., и Хейс, К. С. (2006). Prolyl-tRNAPro в A-сайте SecM-арестованных рибосом ингибирует рекрутирование РНК-мессенджера-переносчика. J. Biol. Chem. 281, 34258–34268.DOI: 10.1074 / jbc.M608052200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гарса-Санчес Ф., Шауб Р. Э., Янссен Б. Д. и Хейс К. С. (2011). тмРНК регулирует синтез фактора спасения рибосом ArfA. Мол. Microbiol. 80, 1204–1219. DOI: 10.1111 / j.1365-2958.2011.07638.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гарса-Санчес, Ф., Шоджи, С., Фредрик, К., и Хейс, К. С. (2009). РНКаза II важна для расщепления мРНК A-сайта во время паузы в рибосомах. Мол. Microbiol. 73, 882–897. DOI: 10.1111 / j.1365-2958.2009.06813.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ge, З., и Карзай, А. В. (2009). Коэволюция множественных взаимодействий между расширенной меткой тмРНК и устойчивой протеазой Lon в Mycoplasma . Мол. Microbiol. 74, 1083–1099. DOI: 10.1111 / j.1365-2958.2009.06923.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гонг, М., Круз-Вера, Л. Р., и Янофски, К. (2007). Фактор рециклинга рибосом и фактор высвобождения 3 способствует падению TnaC-пептидил-тРНК и устраняет задержку рибосом во время индукции триптофаном экспрессии tna оперона в Escherichia coli . J. Bacteriol. 189, 3147–3155. DOI: 10.1128 / JB.01868-06
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Готтесман, С., Рош, Э., Чжоу, Ю., и Зауэр, Р. Т. (1998). Протеазы ClpXP и ClpAP разрушают белки с помощью карбоксиконцевых пептидных хвостов, добавленных системой SsrA-tagging †. Genes Dev. 12, 1338–1347. DOI: 10.1101 / gad.12.9.1338
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гено де Новоа, П., и Уильямс, К. П. (2004). Сайт тмРНК: редуктивная эволюция тмРНК в пластидах и других эндосимбионтах. Nucleic Acids Res. 32, D104 – D108. DOI: 10.1093 / nar / gkh202
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гур Э. и Зауэр Р. Т. (2008). Эволюция тега деградации ssrA в микоплазме: переключение специфичности на другую протеазу. Proc. Natl. Акад. Sci. США 105, 16113–16118. DOI: 10.1073 / pnas.0808802105
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гутманн, С., Хабель, П. В., Метцингер, Л., Саттер, М., Фельден, Б., и Бан, Н. (2003). Кристаллическая структура домена трансфер-РНК транспортной матричной РНК в комплексе с SmpB. Nature 424, 5503–5509. DOI: 10.1038 / nature01831
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ханава-Суэцугу, К., Бордо, В., Химено, Х., Муто, А., и Фельден, Б. (2001). Важность консервативных нуклеотидов в тРНК-подобной структуре РНК передачи Escherichia coli для мечения белков. Nucleic Acids Res. 29, 4663–4673. DOI: 10.1093 / nar / 29.22.4663
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ханава-Суэцугу, К., Такаги, М., Инокучи, Х., Химено, Х. и Муто, А. (2002). SmpB функционирует на различных этапах перевода trans . Nucleic Acids Res. 30, 1620–1629. DOI: 10.1093 / nar / 30.7.1620
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Handa, Y., Hikawa, Y., Tochio, N., Kogure, H., Inoue, M., Koshiba, S., et al. (2010). Структура раствора каталитического домена митохондриального белка ICT1, необходимого для жизнеспособности клеток. J. Mol. Биол. 404, 260–273. DOI: 10.1016 / j.jmb.2010.09.033
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ханда, Ю., Инахо, Н., Намеки, Н. (2011). YaeJ — это новый ассоциированный с рибосомами белок в Escherichia coli , который может гидролизовать пептидил-тРНК на остановившихся рибосомах. Nucleic Acids Res. 39, 1739–1748. DOI: 10.1093 / nar / gkq1097
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Hayes, C. S., Bose, B., and Sauer, R. T. (2002a). Стоп-кодоны, которым предшествуют редкие кодоны аргинина, являются эффективными детерминантами мечения SsrA в Escherichia coli . Proc.Natl. Акад. Sci. США 99, 3440–3445. DOI: 10.1073 / pnas.052707199
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Hayes, C. S., Bose, B., and Sauer, R. T. (2002b). Остатки пролина на С-конце растущих цепей индуцируют SsrA-метку во время терминации трансляции. J. Biol. Chem. 277, 33825–33832. DOI: 10.1074 / jbc.M205405200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Hayes, C.S., Sauer, R.Т. (2003). Расщепление кодона мРНК сайта A во время паузы в рибосомах обеспечивает механизм контроля качества трансляции. Мол. Cell 12, 903–911. DOI: 10.1016 / S1097-2765 (03) 00385-X
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Герман К., Тевене Д., Булок П., Уокер Г. К. и Д’Ари Р. (1998). Расщепление цитоплазматических белков, меченных карбокси-концом, протеазой HflB (FtsH) Escherichia coli . Genes Dev. 12, 1348–1355.DOI: 10.1101 / gad.12.9.1348
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Эургуэ-Хамард, В., Карими, Р., Мора, Л., МакДугалл, Дж., Лебёф, К., Гренцманн, Г., и др. (1998). Фактор высвобождения рибосомы RF4 и фактор терминации RF3 участвуют в диссоциации пептидил-тРНК от рибосомы. EMBO J. 17, 808–816. DOI: 10.1093 / emboj / 17.3.808
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Химено, Х., Сато, М., Тадаки, Т., Фукусима, М., Ушида, К., и Муто, А. (1997). In vitro трансляция , опосредованная заряженной аланином 10Sa РНК. J. Mol. Биол. 268, 803–808. DOI: 10.1006 / jmbi.1997.1011
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Хонг, С.-Дж., Лесснер, Ф. Х., Махен, Э. М. и Кейлер, К. С. (2007). Протеомная идентификация субстратов тмРНК. Proc. Natl. Акад. Sci. США 104, 17128–17133. DOI: 10.1073 / pnas.0707671104
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Hong, S.-Дж., Тран, К. А., и Кейлер, К. (2005). Регулируемая клеточным циклом деградация тмРНК контролируется РНКазой R и SmpB. Мол. Microbiol. 57, 565–575. DOI: 10.1111 / j.1365-2958.2005.04709.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Хуанг К., Вольфганг М. К., Уити Дж., Кумей М. и Фридман Д. И. (2000). Заряженная тмРНК, но не опосредованный тмРНК протеолиз, важен для жизнеспособности Neisseria gonorrhoeae . EMBO J. 19, 1098–1107.DOI: 10.1093 / emboj / 19.5.1098
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Хатчисон, К. А., Петерсон, С. Н., Гилл, С. Р., Клайн, Р. Т., Уайт, О., Фрейзер, К. М. и др. (1999). Глобальный мутагенез транспозонов и минимальный геном микоплазмы. Science 286, 2165–2169. DOI: 10.1126 / science.286.5447.2165
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Иванова Н., Линделл М., Павлов М., Хольмберг Скьявоне Л., Вагнер Э.Г., Эренберг М. (2007). Исследование структуры тмРНК на разных стадиях трансляции транс и . РНК 13, 713–722. DOI: 10.1261 / rna.451507
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Джейкоб, Ю., Шаркади, С. М., Бхардвадж, К., Санда, А. А., и Уильямс, К. П. (2005). Функция хвоста SmpB в трансляции РНК-мессенджера выявляется посредством кодируемой ядром формы. J. Biol. Chem. 280, 5503–5509. DOI: 10.1074 / JBC.M409277200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Jiang, L., Schaffitzel, C., Bingel-Erlenmeyer, R., Ban, N., Korber, P., Koning, R. I., et al. (2009). Рециклинг прерванных комплексов 50S-субъединица рибосом с растущей цепью-тРНК белком теплового шока Hsp15. J. Mol. Биол. 386, 1357–1367. DOI: 10.1016 / j.jmb.2008.10.079
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Карзай, А. В., и Зауэр, Р. Т. (2001).Белковые факторы, связанные с тегированием SsrA-SmpB и комплексом спасения рибосом. Proc. Natl. Акад. Sci. США 98, 3040–3044. DOI: 10.1073 / pnas.051628298
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Карзай, А. В., Сасскинд, М. М., и Зауэр, Р. Т. (1999). SmpB, уникальный РНК-связывающий белок, необходимый для мечения пептидов активности SsrA (тмРНК). EMBO J. 18, 3793–3799. DOI: 10.1093 / emboj / 18.13.3793
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Каур, С., Gillet, R., Li, W., Gursky, R., and Frank, J. (2006). Крио-ЭМ-визуализация передачи матричной РНК с двумя SmpB в застрявшей рибосоме. Proc. Natl. Акад. Sci. США 103, 16484–16489. DOI: 10.1073 / pnas.0607438103
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кейлер, К. К., и Шапиро, Л. (2003a). тмРНК в Caulobacter crescentus — это клеточный цикл, регулируемый посредством временно контролируемой транскрипции и деградации РНК. J. Bacteriol. 185, 1825–1830. DOI: 10.1128 / JB.185.6.1825-1830.2003
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кейлер, К. К., Шапиро, Л., и Уильямс, К. П. (2000). тмРНК, которые кодируют индуцирующие протеолиз метки, обнаружены во всех известных бактериальных геномах: двухкомпонентная тмРНК функционирует в Caulobactor . Proc. Natl. Акад. Sci. США 97, 7778–7783. DOI: 10.1073 / pnas.97.14.7778
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кейлер, К.К., Уоллер П. Р. и Зауэр Р. Т. (1996). Роль системы мечения пептидов в деградации белков, синтезированных из поврежденной информационной РНК. Science 271, 990–993. DOI: 10.1126 / science.271.5251.990
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Когуре, Х., Ханда, Ю., Нагата, М., Канаи, Н., Гюнтерт, П., Кубота, К. и др. (2014). Идентификация остатков, необходимых для восстановления остановившихся рибосом в кодон-независимом факторе высвобождения YaeJ. Nucleic Acids Res. DOI: 10.1093 / nar / gkt1280
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Когуре, Х., Хикава, Ю., Хагихара, М., Точио, Н., Кошиба, С., Иноуэ, Ю., и др. (2012). Структура раствора и siRNA-опосредованный анализ нокдауна белка C12orf65, связанного с митохондриальными заболеваниями. Белки 80, 2629–2642. DOI: 10.1002 / prot.24152
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Комине, Ю., Китабатаке, М., и Инокучи, Х.(1996). 10Sa РНК связана с 70S рибосомными частицами в Escherichia coli . J. Biochem. 119, 463–467. DOI: 10.1093 / oxfordjournals.jbchem.a021264
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Комине, Ю., Китабатаке, М., Йокогава, Т., Нисикава, К., и Инокучи, Х. (1994). ТРНК-подобная структура присутствует в 10Sa РНК, небольшой стабильной РНК из Escherichia coli . Proc. Natl. Акад. Sci. США 91, 9223–9227.DOI: 10.1073 / pnas.91.20.9223
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Конно Т., Курита Д., Такада К., Муто А. и Химено Х. (2007). Функциональное взаимодействие SmpB с тмРНК для определения точки возобновления трансляции . РНК 13, 1723–1731. DOI: 10.1261 / rna.604907
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Конно Т., Такахаши Т., Курита Д., Муто А. и Химено Х.(2004). Минимальная структура аминогликозидов, вызывающая сдвиг инициации трансляции на . Nucleic Acids Res. 32, 4119–4126. DOI: 10.1093 / nar / gkh750
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Курита Д., Сасаки Р., Муто А. и Химено Х. (2007). Взаимодействие SmpB с рибосомой от направленного зондирования гидроксильных радикалов. Nucleic Acids Res. 35, 7248–7255. DOI: 10.1093 / nar / gkm677
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Куроха, К., Хоригучи, Н., Айба, Х., Инада, Т. (2009). Анализ непрерывной трансляции мРНК в отсутствие тмРНК в Escherichia coli . Гены Клеток 14, 739–749. DOI: 10.1111 / j.1365-2443.2009.01304.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ли С., Исии М., Тадаки Т., Муто А. и Химено Х. (2001). Детерминанты на тмРНК для инициации эффективной и точной трансляции trans : некоторые мутации перед кодирующей меткой последовательности тмРНК Escherichia coli сдвигают точку инициации трансляции trans in vitro. РНК 7, 999–1012. DOI: 10.1017 / S1355838201010342
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лесснер, Ф. Х., Вентерс, Б. Дж., И Кейлер, К. С. (2007). Протеолитический адаптер для переноса белков, меченных РНК-мессенджером, из альфа-протеобактерий. J. Bacteriol. 189, 272–275. DOI: 10.1128 / JB.01387-06
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ли, X., Яги, М., Морита, Т., и Айба, Х. (2008). Расщепление мРНК и роль системы тмРНК при аминокислотном голодании у Escherichia coli . Мол. Microbiol. 68, 462–473. DOI: 10.1111 / j.1365-2958.2008.06167.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ли, X., Йокота, Т., Ито, К., Накамура, Ю., и Айба, Х. (2007). Сниженное действие факторов высвобождения полипептидов вызывает расщепление мРНК и мечение тмРНК на стоп-кодонах в Escherichia coli . Мол. Microbiol. 63, 116–126. DOI: 10.1111 / j.1365-2958.2006.05498.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лян, W., и Дойчер, М. П. (2010). Новый механизм регуляции рибонуклеаз: РНК-мессенджер (тмРНК) и связанный с ней белок SmpB регулируют стабильность РНКазы R. J. Biol. Chem. 285, 29054–29058. DOI: 10.1074 / jbc.C110.168641
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лян В., Малхотра А. и Дойчер М. П. (2011). Ацетилирование регулирует стабильность бактериального белка: модификация РНКазы R в зависимости от стадии роста. Mol.Cell 44, 160–166. DOI: 10.1016 / j.molcel.2011.06.037
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мао К., Бхардвадж К., Шаркади С. М., Фиш Р. И., Дрисколл Т., Вауэр Дж. И др. (2009). Вариации гена тмРНК. RNA Biol. 6, 355–361. DOI: 10.4161 / rna.6.4.9172
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Миллер, М. Р., Лю, З., Казье, Д. Дж., Гебхард, Г. М., Херрон, С. Р., Захер, Х. С. и др.(2011). Роль SmpB и центра декодирования рибосом в лицензировании входа тмРНК в застопорившиеся рибосомы. РНК 17, 1727-1736. DOI: 10.1261 / rna.2821711
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мунавар, Х., Чжоу, Ю., и Готтесман, С. (2005). Анализ фенотипа Escherichia coli Alp: индукция теплового шока у мутантов ssrA. J. Bacteriol. 187, 4739–4751. DOI: 10.1128 / JB.187.14.4739-4751.2005
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Муто, А., Фуджихара А., Ито К., Мацуно Дж., Ушида К. и Химено Х. (2000). Потребность в РНК-мессенджере (тмРНК) для роста Bacillus subtilis в условиях стресса. Гены Клеток 5, 627–636. DOI: 10.1046 / j.1365-2443.2000.00356.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Муто А., Сато М., Тадаки Т., Фукусима М., Ушида К. и Химено Х. (1996). Структура и функция бактериальной 10Sa РНК: транс-трансляционная система . Biochimie 78, 985–991. DOI: 10.1016 / S0300-9084 (97) 86721-1
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Муто, Х., Накатогава, Х., Ито, К. (2006). Генетически кодируемая, но неполипептидная пролил-тРНК функционирует в сайте A для SecM-опосредованного рибосомного стойла. Мол. Cell 22, 545–552. DOI: 10.1016 / j.molcel.2006.03.033
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Намеки, Н., Тадаки, Т., Муто, А., и Himeno, H. (1999a). Идентификационный переключатель аминокислотного акцептора тмРНК Escherichia coli тмРНК с аланина на гистидин in vitro. J. Mol. Биол. 289, 1–7. DOI: 10.1006 / jmbi.1999.2754
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Намеки, Н., Фельден, Б., Аткинс, Дж. Ф., Гестеланд, Р. Ф., Химено, Х. и Муто, А. (1999b). Функциональный и структурный анализ псевдоузла перед кодируемой меткой последовательности в тмРНК E. coli. J. Mol. Биол. 286, 733–744. DOI: 10.1006 / jmbi.1998.2487
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Nameki, N., Chattopadhyay, P., Himeno, H., Muto, A., and Kawai, G. (1999c). ЯМР и мутационный анализ псевдоузла РНК E. coli тмРНК, участвующей в трансляции транс, , . Nucleic Acids Res. 27, 3667–3675. DOI: 10.1093 / nar / 27.18.3667
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Намеки, Н., Someya, T., Okano, S., Suemasa, R., Kimoto, M., Hanawa-Suetsugu, K., et al. (2005). Анализ взаимодействия между тмРНК и SmpB из Thermus thermophilus . J. Biochem. 138, 729–739. DOI: 10.1093 / jb / mvi180
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Намеки, Н., Тадаки, Т., Химено, Х., и Муто, А. (2000). Три из четырех псевдоузлов в тмРНК взаимозаменяемы и заменяются одноцепочечными РНК. FEBS Lett. 470, 345–349.DOI: 10.1016 / S0014-5793 (00) 01349-1
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Нойбауэр К., Жилле Р., Келли А. К. и Рамакришнан В. (2012). Расшифровка в отсутствие кодона тмРНК и SmpB в рибосоме. Science 335, 1366–1369. DOI: 10.1126 / science.1217039
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Nonin-Lecomte, S., Germain-Amiot, N., Gillet, R., Hallier, M., Ponchon, L., Dardel, F., et al.(2009). Захват рибосом: роль малого протеина B во время трансляции транс . EMBO Rep. 10, 160–165. DOI: 10.1038 / embor.2008.243
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
О, Б. К., и Апирион, Д. (1991). 10Sa РНК, небольшая стабильная РНК Escherichia coli , является функциональной. Мол. Genet Genet. 25, 737–749.
Pubmed Аннотация | Pubmed Полный текст
Оно, К., Куцукаке, К., и Або, Т.(2009). Подавление за счет повышенной активности RpoE термочувствительного фенотипа двойного мутанта degP ssrA в Escherichia coli . Genes Genet. Syst. 84, 15–24. DOI: 10.1266 / ggs.84.15
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Усенко, И. А., Абэ, Т., Уджие, Х., Муто, А., и Беххофер, Д. Х. (2005). Участие 3′-5′-экзорибонуклеаз в обороте мРНК Bacillus subtilis . J. Bacteriol. 187, 2758–2767.DOI: 10.1128 / JB.187.8.2758-2767.2005
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Палецкова П., Фельсберг Дж., Бобек Дж. И Микулик К. (2007). Обилие тмРНК у Streptomyces aureofaciens, S. griseus и S. collinus в условиях, вызывающих стресс. Folia Microbiol. 52, 463–470. DOI: 10.1007 / BF02932105
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Печ, М., Карим, З., Ямамото, Х., Китакава, М., Цинь, Ю., и Нирхаус, К. Х. (2011). Фактор элонгации 4 (EF4 / LepA) ускоряет синтез белка при повышенных концентрациях Mg 2 + . Proc. Natl. Акад. Sci. США 108, 3199–3203. DOI: 10.1073 / pnas.1012994108
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Педерсен, К., Завьялов, А.В., Павлов, М.Ю., Эльф, Дж., Гердес, К., и Эренберг, М. (2003). Бактериальный токсин RelE демонстрирует кодон-специфическое расщепление мРНК в рибосомном сайте A. Cell 112, 131–140. DOI: 10.1016 / S0092-8674 (02) 01248-5
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Писарева В. П., Скабкин М. А., Хеллен К. У., Пестова Т. В., Писарев А. В. (2011). Диссоциация с помощью Pelota, Hbs1 и ABCE1 вакантных 80S рибосом млекопитающих и остановившихся комплексов элонгации. EMBO J. 30, 1804–1817. DOI: 10.1038 / emboj.2011.93
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Рамадосс, Н.С., Алумаса, Дж. Н., Ченг, Л., Ван, Ю., Ли, С., Чемберс, Б. С. и др. (2013b). Низкомолекулярные ингибиторы трансляции транс- обладают антибиотической активностью широкого спектра. Proc. Natl. Акад. Sci. США 110, 10282–10287. DOI: 10.1073 / pnas.1302816110
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Рамрат Д. Дж., Ямамото Х., Ротер К., Виттек Д., Печ М., Мильке Т. и др. (2012). Комплекс тмРНК-SmpB и EF-G на транслокационных рибосомах. Природа 485, 526–529. DOI: 10.1038 / природа11006
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ранке, К., и Готтесман, С. (2007). Трансляционная регуляция RpoS стрессового фактора Escherichia coli : роль SsrA и Lon. J. Bacteriol. 189, 4872–4879. DOI: 10.1128 / JB.01838-06
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Реццонико, Э., Лариани, С., Барретто, К., Куануд, Г., Жилиберти, Г., Делли М. и др. (2007). Глобальный транскриптомный анализ ответа на тепловой шок Bifidobacterium longum . FEMS Microbiol. Lett. 271, 136–145. DOI: 10.1111 / j.1574-6968.2007.00704.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ричардс Дж., Мехта П. и Карзай А. В. (2006). РНКаза R избирательно деградирует нон-стоп мРНК SmpB-tmRNA-зависимым образом. Мол. Microbiol. 62, 1700–1712. DOI: 10.1111 / j.1365-2958.2006.05472.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Рихтер, Р., Рорбах, Дж., Паяк, А., Смит, П. М., Весселс, Х. Дж., Хьюнен, М. А. и др. (2010). Функциональная пептидил-тРНК гидролаза, ICT1, была задействована в митохондриальной рибосоме человека. EMBO J. 29, 1116–1125. DOI: 10.1038 / emboj.2010.14
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Рош, Э. Д., и Зауэр, Р. Т. (2001). Идентификация эндогенных белков, меченных SsrA, выявляет метку в положениях, соответствующих стоп-кодонам. J. Biol. Chem. 276, 28509–28515. DOI: 10.1074 / jbc.M103864200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Rudinger-Thirion, J., Giegé, R., and Felden, B. (1999). Аминоацилированная тмРНК из Escherichia coli взаимодействует с прокариотическим фактором элонгации Tu. РНК 5, 989–992. DOI: 10.1017 / S135583829999101X
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ши В., Чжан Х., Цзян Х., Юань Х., Ли, Дж. С., Барри, К. Э. III и др. (2011). Пиразинамид ингибирует трансляцию транс- в Mycobacterium tuberculosis . Наука 333, 1630–1632. DOI: 10.1126 / science.1208813
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Шин, Дж. Х., и Прайс, К. У. (2007). Система спасения рибосом SsrA-SmpB важна для роста Bacillus subtilis при низкой и высокой температуре. J. Bacteriol. 189, 3729–3737.DOI: 10.1128 / JB.00062-07
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сингх, Н. С., Ахмад, Р., Сангита, Р., и Варшни, У. (2008). Рециклинг рибосомных комплексов остановился на стадии элонгации в Escherichia coli . J. Mol. Биол. 380, 451–464. DOI: 10.1016 / j.jmb.2008.05.033
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сингх, Н. С., Варшней, У. (2004). Физиологическая связь между тмРНК и пептидил-тРНК гидролазой функционирует в Escherichia coli . Nucleic Acids Res. 32, 6028–6037. DOI: 10.1093 / nar / gkh924
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Шумейкер, К. Дж., Эйлер, Д. Э. и Грин, Р. (2010). Dom34: Hbs1 способствует диссоциации субъединиц и падению пептидил-тРНК, инициируя непрекращающийся распад. Наука 330, 369–372. DOI: 10.1126 / science.1192430
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сома, А., Онодера, А., Сугахара, Дж., Канаи, А., Ячи Н., Томита М. и др. (2007). Пермутированные гены тРНК экспрессируются через промежуточную кольцевую РНК в Cyanidioschyzon merolae . Наука 19, 450–453. DOI: 10.1126 / science.1145718
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Someya, T., Nameki, N., Hosoi, H., Suzuki, S., Hatanaka, H., Fujii, M., et al. (2003). Структура раствора тмРНК-связывающего белка, SmpB, из Thermus thermophilus . FEBS Lett. 535, 94–100.DOI: 10.1016 / S0014-5793 (02) 03880-2
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сунохара, Т., Дзодзима, К., Ямамото, Ю., Инада, Т., и Айба, Х. (2002). Опосредованная растущим пептидом задержка рибосомы на стоп-кодоне индуцирует расщепление мРНК, что приводит к безостановочной мРНК, которая распознается тмРНК. РНК 10, 378–386. DOI: 10.1261 / rna.5169404
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сунохара, Т., Дзёдзима, К., Ямамото, Ю., Инада, Т., и Айба, Х. (2004a). Опосредованная растущим пептидом задержка рибосомы на стоп-кодоне индуцирует расщепление мРНК, что приводит к безостановочной мРНК, которая распознается тмРНК. РНК 10, 378–386. DOI: 10.1261 / rna.5169404
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сунохара, Т., Джодзима, К., Тагами, Х., Инада, Т., и Айба, Х. (2004b). Остановка рибосом во время элонгации трансляции индуцирует расщепление транслируемой мРНК в Escherichia coli . J. Biol. Chem. 279, 15368–15375. DOI: 10.1074 / jbc.M312805200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Тадаки Т., Фукусима М., Ушида К., Химено Х. и Муто А. (1996). Взаимодействие 10Sa РНК с рибосомами в Escherichia coli . FEBS Lett. 399, 223–226. DOI: 10.1016 / S0014-5793 (96) 01330-0
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Такада, К., Такемото, К., Кавазоэ, М., Конно, Т., Ханава-Суэцугу, К., Ли, С. и др. (2007). In vitro trans — трансляция Thermus thermophilus : рибосомный белок S1 не требуется для ранней стадии трансляции trans . РНК 13, 503–510. DOI: 10.1261 / rna.363207
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Такахаши Т., Конно Т., Муто А. и Химено Х. (2003). Различные эффекты паромомицина на тмРНК-направленную трансляцию транс . J. Biol. Chem. 278, 27672–27680. DOI: 10.1074 / jbc.M211724200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Тибонье, М., Тиберж, Дж. М., и Де Реус, Х. (2008). Trans — трансляция в Helicobacter pylori : необходимость спасения рибосом и необходимость маркировки белков для устойчивости к стрессу и компетентности. PLoS ONE 3: e3810. DOI: 10.1371 / journal.pone.0003810
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Вт, г.Ф., Рид, Г. Э., Чжан, Дж. Г., Мориц, Р. Л., и Симпсон, Р. Дж. (1995). С-концевое удлинение усеченных рекомбинантных белков в Escherichia coli с декапептидом 10Sa РНК. J. Biol. Chem. 270, 9322–9326. DOI: 10.1074 / jbc.270.16.9322
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Удэ С., Лассак Дж., Староста А. Л., Краксенбергер Т., Уилсон Д. Н. и Юнг К. (2013). Фактор удлинения трансляции EF-P снижает задержку рибосом при растяжении полипролина. Наука 339, 82–85. DOI: 10.1126 / science.1228985
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Уэда К., Ямамото Ю., Огава К., Або Т., Инокучи Х. и Айба Х. (2002). Бактериальная система SsrA играет роль в преодолении нежелательного чтения трансляции, вызванного супрессорными тРНК. Гены Клеток 7, 509–519. DOI: 10.1046 / j.1365-2443.2002.00537.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Удзиэ, Х., Matsutani, T., Tomatsu, H., Fujihara, A., Ushida, C., Miwa, Y., et al. (2009). Трансляция Trans участвует в CcpA-зависимой маркировке и деградации TreP в Bacillus subtilis . J. Biochem. 145, 59–66. DOI: 10.1093 / jb / mvn143
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ушида К., Химено Х., Ватанабэ Т. и Муто А. (1994). тРНК-подобные структуры в 10Sa РНК Mycoplasma capricolum и Bacillus subtilis . Nucleic Acids Res. 22, 3392–3396. DOI: 10.1093 / nar / 22.16.3392
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Вайс, Ф., Брон, П., Роллан, Дж. П., Томас, Д., Фельден, Б., и Жилле, Р. (2010a). Размещение тмРНК-SmpB в остановившихся рибосомах: крио-ЭМ исследование. РНК 16, 299–306. DOI: 10.1261 / rna.1757410
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Weis, F., Bron, P., Giudice, E., Rolland, J. P., Thomas, D., Felden, B., et al. (2010b). тмРНК-SmpB: путешествие к центру бактериальной рибосомы. EMBO J. 29, 3810–3818. DOI: 10.1038 / emboj.2010.252
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Уильямс, К. П., Мартиндейл, К. А., и Бартель, Д. П. (1999). Возобновление трансляции на тмРНК: уникальный способ определения рамки считывания. EMBO J. 18, 5423–5433. DOI: 10.1093 / emboj / 18.19.5423
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Вауэр, И.К., Цвиб К. и Вовер Дж. (2004). Вклад псевдоузлов и белка SmpB в структуру и функцию тмРНК при трансляции транс и . J. Biol. Chem. 279, 54202–54209. DOI: 10.1074 / jbc.M410488200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Wower, I.K., Zwieb, C.W., Guven, S.A., and Wower, J. (2000). Связывание и перекрестное связывание тмРНК с рибосомным белком S1 на рибосоме Escherichia coli и за ее пределами. EMBO J. 19, 6612–6621. DOI: 10.1093 / emboj / 19.23.6612
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ямамото, Ю., Сунохара, Т., Додзима, К., Инада, Т., и Айба, Х. (2003). SsrA-опосредованная трансляция trans играет роль в контроле качества мРНК, облегчая деградацию укороченных мРНК. РНК 9, 408–418. DOI: 10.1261 / rna.2174803
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Замедленный распад мРНК увеличивает специфическую трансляцию тромбоцитов | Кровь
Тромбоциты — это небольшие фрагменты клеток в большом количестве, которые циркулируют в крови и поддерживают гемостаз.Когда они сталкиваются с молекулярными маркерами повреждения, они активируют множество функций образования сгустков, включая морфологические изменения, адгезию и секрецию. Растущие тромбоциты образуются во время созревания цитоплазмы мегакариоцитов (МК) костного мозга и выбрасываются в кровоток в огромных количествах каждый день. 1,2 Недавно выпущенные («сетчатые») тромбоциты сохраняют МК-производную РНК 3 ; эта сетчатая субпопуляция наиболее очевидна, когда скорость тромбопоэза повышается, что происходит после острой кровопотери 4 или во время тромбоцитопении. 5-11 Поскольку тромбоциты не способны синтезировать транскрипты новой матричной РНК (мРНК) или собирать новые рибосомы, количество РНК, происходящей из МК, в тромбоцитах постепенно снижается в течение нескольких дней. 10,12,13 Это массовое уменьшение РНК в основном отражает клиренс рибосом (и составляющей рибосомной РНК [рРНК]), подобно процессу созревания, который происходит в ретикулоцитах во время терминальной дифференцировки. 14-16 Механизмы распада мРНК и рибосом в тромбоцитах не известны.Зависимые от аутофагии процессы деградации рибосом были идентифицированы в дрожжах 17 , а также в ретикулоцитах 14 , где дефектный клиренс рибосом или органелл связан с легкой анемией, а у мышей — с повышенным содержанием гемоглобина. 14 Интересно, однако, что ассоциированная с рибосомами эндонуклеаза SLFN14 (которая предположительно отличается от аппарата, связанного с аутофагией), как предполагается, участвует в деградации рРНК в ретикулоцитах, 18 и недавно была вовлечена в функциональную недостаточность тромбоцитов. и тромбоцитопения у людей. 19,20 Эти наблюдения предполагают, что тромбоциты используют другой механизм клиренса рибосом, чем ретикулоциты.
Используя секвенирование РНК следующего поколения (RNA-Seq), работа нескольких групп значительно расширила наши знания 21,22 транскриптома тромбоцитов, подтвердив, что его сложность сопоставима с типичной клеткой млекопитающих 23-27 и формируется регуляторными процессами, такими как сортировка мРНК МК 28 и регуляция микроРНК. 29 Как и мРНК в других тканях, мРНК тромбоцитов помечены 5 ‘m 7 G-caps 30 и 3’polyA-хвостами, 25,31 , которые являются важными признаками, распознаваемыми эукариотическим трансляционным аппаратом. Были описаны многочисленные конкретные примеры белков, синтезируемых тромбоцитами, 32-36 , и был изучен активный путь микроРНК 26,27,29,37,38 и вовлечен в регуляцию распада и трансляции мРНК в тромбоцитах. 29
Поскольку технически сложно изучать популяции тромбоцитов разного возраста in vivo, исследования 39 RNA-Seq сообщили об усредненном «ансамблевом» транскриптах тромбоцитов, на которые влияет возрастное распределение циркулирующих тромбоцитов во время отбора пробы. коллекция.Учитывая документально подтвержденный клиренс РНК тромбоцитами в течение первых нескольких дней циркуляции, 3,10,12 кажется вероятным, что синтез белка тромбоцитов в основном происходит в течение нескольких дней после высвобождения из МК. 11,13 Однако существуют некоторые свидетельства трансляции в более старых тромбоцитах. 40 Это время сравнимо с течением синтеза белка и последующей остановкой трансляции во время созревания ретикулоцитов, 41,42 , что, как предполагалось, вызвано либо клиренсом рибосом 14 , либо накоплением неактивных рибосом. 43
Здесь мы объединяем профилирование рибосом с секвенированием мРНК, чтобы исследовать активную экспрессию генов в первичных тромбоцитах. Мы обнаружили, что тромбоциты наследуют подмножество мРНК МК и транслируют эти транскрипты, хотя опубликованные данные масс-спектрометрии показывают, что накопление белковых продуктов смещено в сторону тех, которые действуют в тромбоцитах, и от, например, ядерных компонентов. Наши данные предполагают, что активация тромбина увеличивает объемный синтез белка и приводит к мРНК-специфической трансляционной активации и репрессии.Мы моделируем производство тромбоцитов в культуре и обнаруживаем заметную роль распада как мРНК, так и рРНК, указывая на потерю экспрессии генов как молекулярную особенность созревания и старения тромбоцитов. Наконец, мы показываем, что распад РНК в тромбоцитах модулируется фактором спасения и контроля качества рибосом Pelota (PELO), который, как мы показали, играет особую роль в трансляции тромбоцитов и ретикулоцитов.
Трансляция в дистальных отростках астроцитов устанавливает молекулярную неоднородность на глиоваскулярном интерфейсе
Мыши
Tg (Aldh2l1-eGFP / Rpl10a) JD130Htz (MGI: 5496674) (Aldhl1: L10a-eGFP) были получены из лаборатории Рокфеллера Хейнтца , Нью-Йорк, США) и содержали в условиях, свободных от патогенов.Этот штамм мышей был создан трансгенезом бактериальной искусственной хромосомы (ВАС) [21, 63]. Протокол генотипирования описан на сайте проекта bacTRAP: www.bactrap.org . Мыши C57BL6 были приобретены в Janvier Labs (Франция) и содержались в условиях, свободных от патогенов.
Антитела
См. Дополнительную таблицу S5, где приведены ссылки на антитела и их применение.
Одобрение исследования
Описанные здесь эксперименты и методы соответствовали этическим правилам Французского агентства экспериментов на животных.
Выделение сосудов головного мозга
Механическую очистку сосудов головного мозга от двухмесячных мышей проводили, как описано ранее [19]. При использовании мышей Aldhl1: L10a-eGFP во все буферы добавляли объем 100 мкл мл циклогексимида -1 (см. Ниже). Сосуды головного мозга, подвергнутые перевариванию базальной пластинки, были получены при замене механической гомогенизации мозга на 45-минутное расщепление с помощью DNAseI (Sigma, St Louis, MO, USA) (20 U мл -1 ) и Liberase DL (Dispase Low, Sigma; 37.5 мкг мл -1 ) в HBSS (Life Technology) при 37 ° C.
Флуоресцентный датчик высокого разрешения
in situ гибридизация с помощью РНКскопа (FISH by RNAscope)FISH проводили на замороженных срезах мозга или очищенных сосудах мозга, иммобилизованных на предметном стекле, покрытом Cell Tak (Корнинг, Корнинг, Нью-Йорк, США). следуя процедурам RNAscope (Advanced Cell Diagnostics, Inc., Ньюарк, Калифорния, США). Гибридизацию зонда против гена дигидродипиколинатредуктазы (dapB) Bacillus subtilis использовали в качестве отрицательного контроля.По крайней мере, три независимых эксперимента были выполнены и отображены. Список датчиков приведен в разделе «Дополнительная информация».
Click-iT HPG Анализ синтеза флуоресцентного белка Alexa
Механически очищенные сосуды головного мозга четырех двухмесячных C57BL6 [19] ресуспендировали в среде DMEM без метионина (Thermo Fisher, Waltham, MA, USA) с гомопропарглиглицином (HPG) , Ингибиторы РНКазы (Thermo Fisher) и ингибиторы протеаз, не содержащие ЭДТА (Roche, Boulogne-Billancourt, Франция), в соответствии с инструкциями производителя и инкубировали 1 час при 37 ° C при осторожном вращении.Затем сосуды промывали PBS, фиксировали в PBS / PFA 4% в течение 15 минут и повышали проницаемость в PBS / Triton X-100 0,5% в течение 20 минут при комнатной температуре. Включение HPG было выявлено с помощью реакционного коктейля Click-iT в соответствии с инструкциями производителя. Ядра окрашивали Hoechst (1: 2000), а поверхность сосудов — изолектином GS-B4 (1: 100). Специфичность мечения HPG оценивалась при инкубации сосудов головного мозга с нормальной DMEM, содержащей метионин, или с 500 мкг мл -1 HPG и 500 мкг мл -1 Циклогексимид (Sigma) в течение 30 минут при 4 ° C до и во время инкубация.Были выполнены и отображены три независимых эксперимента.
Исследование на микрочипах
Суммарные РНК были извлечены из двухмесячных сосудов головного мозга C57BL6, подвергнутых или не подвергнутых расщеплению базальной пластинки, с использованием набора для ткани Rneasy Lipid (Qiagen, Германия, Hilden). Четыре независимых библиотеки были приготовлены для каждого условия на очищенных сосудах, собранных от четырех мышей. Наборы данных Affymetrix Mouse Gene 2.0 Array контролировались с помощью консоли Expression (Affymetrix, Санта-Клара, Калифорния, США), а дальнейший анализ и визуализация выполнялись с помощью EASANA (GenoSplice Technology, www.genosplice.com), который основан на аннотациях FAST DB GenoSplice [64]. Данные генного массива нормализовали с использованием квантильной нормализации. Фоновые поправки были сделаны с помощью антигеномных зондов, выбранных, как описано ранее [64]. Только зонды, нацеленные на экзоны, аннотированные из транскриптов FAST DB (выпуск 2015_1), были отобраны, чтобы сосредоточиться на хорошо аннотированных генах, чьи последовательности мРНК находятся в общедоступных базах данных [64]. Отобранные некачественные зонды (например, зонды, помеченные Affymetrix как «перекрестная гибридизация») и зонды, для которых интенсивность сигнала была слишком низкой по сравнению с зондами антигеномного фона с таким же содержанием GC, были исключены из анализа.Для статистического анализа рассматривались только зонды со значением DABG P ≤0,05, по крайней мере, в половине массивов [64]. Мы провели непарный тест Стьюдента t , чтобы сравнить интенсивность генов в различных биологических повторностях. Гены считались значительно регулируемыми, когда кратность изменения была ≥2 и нескорректированное значение P ≤0,05. Для иерархической кластеризации для каждого регулируемого гена рассчитывали расстояние от сигнала гена в данном образце до соответствующего среднего значения во всех образцах.Соответствующие значения были отображены и сгруппированы с MeV4.9.0 из Института исследований генома с использованием евклидова расстояния и кластеризации среднего сцепления. Файлы необработанных данных доступны в репозитории GEO (www.ncbi.nlm.nih.gov/geo/) под инвентарным номером GSE76299.
GO анализирует
Мы использовали базу данных Pathway Studio ResNet для анализа текста (Ariadne Genomics, Rockville, MD, USA) и инструмент GSEA [65] в Pathway Studio 11.0.5 [66] для выявления чрезмерно представленных сигнальных путей и биологических процессов. в пределах нашего дифференциально выраженного набора данных.В качестве параметров для метода GSEA мы выбрали тест Манна – Уитни U , порог значения P , равный 0,05.
Aldhl1: l10a-eGFP TRAP РНК секвенирование и анализ
Один весь мозг использовали для каждой экстракции полисома целых астроцитов ( n = 3 библиотеки). Перед удалением сосудистое сплетение было удалено. Для экстракции полисом на концах конечностей сосуды головного мозга, очищенные от восьми мышей, объединяли ( n = 6 библиотек). Экстракцию полисомов проводили в соответствии с протоколом, описанным на сайте проекта bacTRAP: www.bactrap.org и Heiman et al. [22], за исключением того, что сосуды гомогенизировали в гомогенизаторе из тефлонового стекла объемом 2 мл за 25 ходов вместо 12 для всего мозга.
Подготовка библиотеки и секвенирование Illumina
10 нг полисомальных РНК были амплифицированы и преобразованы в кДНК с использованием набора NuGEN Ovation RNA-Seq. После амплификации 1 мкг кДНК фрагментировали до ~ 300 п.н. с использованием Covaris S200. Остальная часть подготовки библиотеки была выполнена с использованием 200 нг кДНК после набора TruSeq RNA Sample Prep v2 на этапе восстановления конца.Библиотеки были объединены 3 на 3 дорожки проточных кювет. Секвенирование чтения 50 п.н. выполняли на устройстве HiSeq 1500 (Illumina, San Diego, CA, USA). Среднее значение 72 ± 17 миллионов показаний фильтра качества Illumina было получено для каждого из девяти образцов.
Биоинформатический анализ RNASeq
Анализы проводились с использованием конвейера Eoulsan [67], включая фильтрацию считывания, отображение, фильтрацию выравнивания, количественную оценку считывания. Перед отображением были удалены чтения ≤40 баз, а чтения со средним качеством ≤30 отбрасывались.Затем считывания были сопоставлены с геномом Mus musculus (версия Ensembl 75 мм10) с использованием Bowtie (версия 0.12.9, параметры -n 2 -l 34 -e 70 -k 2 -best) [68]. Выравнивания из считываний, совпадающих более одного раза в эталонном геноме, были удалены с помощью Java-версии программы sam tools [69]. Для расчета экспрессии гена использовалась аннотация генома Mus musculus GFF3 версии mm10 version75 из базы данных Ensembl. Все перекрывающиеся области между выравниванием и ссылочными генами подсчитывали с использованием HTSeq-count 0.5.3 [70].Данные по экспрессии гена RNASeq и необработанные файлы fastq доступны в репозитории GEO (www.ncbi.nlm.nih.gov/geo/) под номером доступа: GSE7293.
Анализ дифференциальной экспрессии генов
Для двух разных групп образцов (концы ножек против астроцитов) мы оценили, какие гены демонстрируют статистически значимую дифференциальную экспрессию, с помощью пакета Bioconductor DESeq2 (версия 1.4.5), написанного для среды статистического программирования R. DESeq2 предполагает, что количество последовательностей РНК распределено согласно отрицательному биномиальному распределению.Он использует обобщенное линейное моделирование для проверки индивидуальных нулевых гипотез о логарифмических 2 -кратных изменениях нуля между условиями для каждого гена [71]. Анализ пути проводили, как описано выше.
Иммуногистометрирование и конфокальная визуализация
На срезах мозга
Для иммуноокрашивания после FISH срезы промывали в PBS, следуя процедуре FISH, и инкубировали 1 час при комнатной температуре в блокирующем растворе (1 мг мл -1 альбумина бычьей сыворотки, 0.2% козьей сыворотки, 0,3% Triton X-100 в PBS). Для простого иммуноокрашивания криосрезы фиксировали в PBS / PFA 4% в течение 15 минут, промывали в PBS и инкубировали 1 час при комнатной температуре в блокирующем растворе (2% козья сыворотка, 0,2% Triton X-100 в PBS). Затем срезы инкубировали с первичными антителами, разведенными в блокирующем растворе, 12 часов при 4 ° C, промывали три раза по 5 минут в PBS, инкубировали вторичные антитела, разведенные в блокирующем растворе 2 часа при комнатной температуре, промывали три раза по 5 минут в PBS и монтировали. в компании Fluoromount (Southern Biotech, Бирмингем, Алабама, США).Изображения были получены на конфокальном микроскопе SP5 (Leica, Wetzlar, Германия) и деконволютированы с помощью программного обеспечения Huygens (Scientific Volume Imaging b.v., Hilversum, Нидерланды). Для анализа Гольджи, трехмерное восстановление и вычисление процессов длины были выполнены с использованием программного обеспечения IMOD [31]. Центр ядра использовался в качестве начальной точки для расчета длины PvAP и процессов Гольджи. Учитывались только PvAP с непрерывной маркировкой GFAP. Последняя точка маркировки считалась концом ветви Гольджи, когда Гольджи был прерван.Были отображены и проанализированы 44 астроцита у четырех мышей.
На очищенных сосудах головного мозга
Очищенные сосуды головного мозга иммобилизовали на предметном стекле, покрытом Cell Tak (Corning), и проводили иммуноокрашивание, как описано для срезов мозга.
Количественная RT-PCR
Суммарные РНК экстрагировали из 2-месячных сосудов головного мозга, очищенных C57BL6, подвергнутых или не подвергнутых расщеплению базальной пластинки, с использованием набора тканей RNeasy Lipid (Qiagen). кДНК синтезировали из 1 мкг РНК с использованием Reverse Transcriptase Superscript II (Thermo Fisher) и случайных праймеров.Образцы кДНК разбавляли добавлением 100 мкл буфера с низким содержанием ТЕ (10 мМ Трис; 0,1 мМ ЭДТА; pH = 8,0) (TEKnova, Холлистер, Калифорния, США) и хранили при -20 ° C. ПЦР выполняли в трех экземплярах на цикле- ре LC480 Roche Light на 2 мкл кДНК с использованием мастер-микса SybrGreen (Roche). Циклы составляли 50 ° C в течение 2 минут, 95 ° C в течение 10 минут и 40 циклов при 95 ° C в течение 15 с и 60 ° C в течение 1 минуты. Относительное количество амплифицированной кДНК было рассчитано как 2 -ΔCt , где ΔCt (изменение порога цикла) равно Ct в сосудах мозга минус Ct в переваренных сосудах мозга.Результаты выражены как средние значения 2 — ΔCt протестированной кДНК / 2 — ΔCt РНК18s. Эксперименты проводились на трех независимых пулах сосудов головного мозга, очищенных как минимум от четырех мышей. Статистические данные проводились с использованием двустороннего критерия Манна – Уитни * для значений P = 0,05. Указаны средние значения ± s.e.m.
Праймеры: AQP4 вперед 5′- IndexTermCTTTCTGGAAGGCAGTCTCAG-3 ‘, AQP4 обратный 5′- IndexTermCCACACCGAGCAAAACAAAGAT-3′, 5’-GFAP вперед IndexTermGGGGCAAAAGCACCAAAGAAG-3 ‘, 5′-GFAP обратный IndexTermGGGACAACTTGTATTGTGAGCC-3′, 5’- Cldn5 вперед IndexTermTAAGGCACGGGTAGCACTCA -3 ‘, Cldn5 обратный 5′- IndexTermGGACAACGATGTTGGCGAAC-3′, Acta2 прямой 5’- IndexTermGTCCCAGACATCAGGGAGTAA-3 ‘, Acta2 обратный 5′- IndexTermTCGGATACTTCAGCTT-TCAGGA-3’, RGNAGAG18s index 5 ‘ РНК 18s меняет 5’-IndexTermACATTGTTCCAACATGCCAG-3 ‘.
Вестерн-блот
Очищенные сосуды головного мозга гомогенизировали в PBS, содержащем 2% SDS и полный ингибитор протеазы без ЭДТА (Roche), обрабатывали ультразвуком три раза при 20 Гц (Vibra cell VCX130) и центрифугировали 20 мин при 10 000 g при 4 ° С. Супернатанты кипятили в загрузочном буфере Лэммли. Содержание белка измеряли с использованием реагента для анализа белка Pierce 660 нм (Thermo Scientific, Waltham, MA, USA). Равные количества белков разделяли денатурирующим электрофорезом в 4–12% градиентном геле NuPAGE (Thermo Fisher) и электропереносили на нитроцеллюлозные мембраны.Мембраны анализировали, как описано ранее [72]. Активность HRP визуализировали с помощью ECL с использованием системы Western Lightning plus с усиленной хемолюминесценцией (Perkin Elmer, Waltham, MA, USA). Хемолюминесцентное изображение было выполнено на LAS4000 (Fujifilm, Minato-ku, Tokyo, Japan). Экспрессия гистона 2a или 3 использовалась в качестве эталона нагрузки. Все эксперименты были выполнены в трех повторностях ( n = 3). n представляет собой пул сосудов головного мозга, очищенных как минимум от четырех мышей. Статистические данные проводились с использованием двустороннего критерия Манна – Уитни * для P = 0.05. Указаны средние значения ± s.e.m.
Электронная микроскопия
Двухмесячных мышей C57BL6 анестезировали кетамином / ксилазином (140/8 мг кг -1 , внутрибрюшинно) и транскардиально перфузировали фиксатором (2% параформальдегид, 3% глутаральдегид, 3 мМ CaCl). 2 в 0,1 М какодилатном буфере pH 7,4) в течение 12 мин. Мозг удаляли и оставляли на ночь при 4 ° C в том же фиксаторе. Затем фрагменты мозга (0,3 × 1 × 1 мм 3 ) сначала постфиксировали в 0,1 М какодилатном буфере, pH 7.4 + 1% OsO4 в течение 1 ч при 4 ° C, а затем в 1% водном растворе уранилацетата в течение 2 ч при комнатной температуре (RT). После дегидратации в градуированном этаноле, а затем в оксиде пропилена фрагменты были внедрены в Epon. Были приготовлены ультратонкие (80 нм) срезы, окрашены в цитрате свинца и сфотографированы в просвечивающем электронном микроскопе Jeol 100S (Jeol, Croissy-sur-Seine, Франция), оборудованном 2x2k-камерой Orius 830 CCD (Roper Scientific, Эври, Франция). ). Было проанализировано 78 астроцитов трех мышей.
Для иммунолокализации GM130 мозг фиксировали транскардиальной перфузией фиксатора (4% параформальдегид, 0.2% глутарового альдегида в 0,1 М фосфатном буфере (pH 7,4), затем удаляли и фиксировали еще 2 ч при 4 ° C в 4% параформальдегиде. Срезы вибратома (70 мкм) подвергали криозащите в 30% сахарозе (три смены за 24 часа) и замораживали / размораживали в жидком азоте. Все последующие процедуры проводились в RT. После обширной промывки и нейтрализации свободных альдегидных групп в 100 мМ глицине срезы головного мозга инкубировали последовательно в 10% козьей сыворотке в течение 2 часов с первичным мышиным антителом против GM130 (BD Biosciences Cat # 610822 RRID: AB_398141) (1: 250) для 24 часа и биотинилированное козье вторичное антитело против мыши (Jackson Immunoresearch, West Grove, PA, USA) (1: 1000) в течение 24 часов.Окрашивание было обнаружено с помощью набора Vectastain Elite ABC (CliniSciences SAS, Нантер, Франция) в соответствии с инструкциями производителя. Затем срезы постфиксировали сначала в 2,5% глутаровом альдегиде в течение 30 минут при комнатной температуре, а затем в 0,5% OsO4 в течение 30 минут при 4 ° C перед дегидратацией и плоской заделкой в Epon, как подробно описано в предыдущем разделе. Квадраты размером 1 2 были вырезаны из встроенных срезов в области коры головного мозга и приклеены к блоку Epon для срезов на ультрамикротоме. Наблюдались ультратонкие срезы без окрашивания свинцом.
Структурная основа сдвига рамки рибосомы во время трансляции генома РНК SARS-CoV-2
( A ) Поперечное сечение структуры рибосомы с псевдоузлом, показывающее выходной туннель. Возникающий C-конец Nsp10 (оранжевый) и N-конец Nsp11 / Nsp12 (фиолетовый) видны от PTC до периферии выходного туннеля рибосомы (LSU в синем). ( B ) Схематическое изображение пути растущего пептида вдоль выходного туннеля. Arg 4387 складывается из 28 остатков рРНК S A 1555 на сайте сужения.Далее вниз, где туннель расширяется, C-концевой домен цинкового пальца Nsp10 сворачивается котрансляционно, при этом Trp 4376 укладывается на A 2261 из 28 S рРНК. ( C ) Хорошо упорядоченная плотность видна для Arg 4387 Nsp10, когда он складывается на A 1555 из 28 S рРНК в месте сужения и стабилизируется Leu 4386 . Структура показана на крио-ЭМ карте с двумя контурами (серым и красным).( D и E ) Наложение котрансляционно свернутого домена цинкового пальца с кристаллической структурой Nsp10 [зеленый, PDB 2FYG ( 37 )] показывает структурное сходство. ( F ) Исследование роли взаимодействий зарождающейся цепи с выходным туннелем рибосомы с использованием системы RRL in vitro. Мутации взаимодействующих остатков тестировали на предмет их влияния на сдвиг рамки, показанный по сравнению со сдвигом рамки дикого типа (41% сдвиг рамки был нормализован до 100%).Замена всей зарождающейся цепи несвязанной последовательностью приводит к относительному увеличению сдвига кадра на 35%, что лишь частично связано с потерей 5′-контура аттенюатора. Взаимодействия вокруг сайта сжатия, вероятно, служат для ослабления сдвига кадра, потому что замена взаимодействующего Arg 4387 и стабилизации Leu 4386 (LR) на Ala (AA) увеличивает сдвиг кадра на 30%. Планки погрешностей представляют собой стандартное отклонение. NS, не имеет значения, и ** P t испытание.( G ) Выравнивание SARS2 с близкородственными последовательностями других коронавирусов, подчеркивающее сохранение мутантных остатков [окрашено как в (F)]. Показанный участок последовательности охватывает C-концевой домен цинкового пальца Nsp10 (оранжевый) и части Nsp11 / Nsp12 (фиолетовый), видимые в нашей реконструкции. Остатки растущей цепи Leu 4386 и Arg 4387 , которые взаимодействуют с выходным туннелем рибосом, строго консервативны, тогда как консервативность соседних остатков ниже.Звезды представляют четыре цистеина цинкового пальца Nsp10. Однобуквенные сокращения аминокислотных остатков следующие: A, Ala; C, Cys; D, Asp; E, Glu; F, Phe; G, Gly; H, Его; Я, Иль; К, лиз; L, лей; M, Met; N, Asn; P, Pro; Q, Gln; R, Арг; S, Ser; Т, Тр; V, Val; W, Trp; и Y, Tyr.Купить — Комплект для переоборудования Duclos RF Mount для Fujinon MK-R Zooms
——— Популярное ———————— Великобритания ——— ЕВРОПА ——- —————- АвстрияБельгияБолгарияХорватияКипрЧешская республикаДанияЭстонияФинляндияФранцияГерманияГрецияВенгрияИрландияИталияЛатвияЛитваЛюксембургМальтаНидерландыПольшаПортугалияРумынияСловенияСловенияИспанияШвеция ——— ОТДЫХ МИРА ——————— — AfghanistanAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntigua и BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelarusBelgiumBelizeBeninBermudaBhutanBoliviaBosnia и HerzegovinaBotswanaBrazilBrunei DarussalamBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCanary IslandsCape VerdeCayman IslandsCentral Африканский RepublicChadChileChinaColombiaComorosCongoCook IslandsCosta RicaCote D’IvoireCroatiaCubaCyprusCzech RepublicDemocratic Республика CongoDenmarkDjiboutiDominicaDominican RepublicEcuadorEgyptEl SalvadorEquatorial GuineaEritreaEstoniaEthiopiaFaroe IslandsFijiFinlandFranceFrench GuianaGabonGambiaGeor giaGermanyGhanaGibraltarGreeceGreenlandGrenadaGuadeloupeGuamGuatemalaGuernseyGuineaGuinea-BissauGuyanaHaitiHondurasHong KongHungaryIcelandIndiaIndonesiaIranIraqIrelandIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKorea, Республика ofKosovoKuwaitKyrgyzstanLatviaLebanonLesothoLiberiaLibyaLiechtensteinLithuaniaLuxembourgMacaoMacedoniaMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMexicoMicronesiaMoldovaMonacoMongoliaMontenegroMontserratMoroccoMount Афон — GreeceMozambiqueMyanmarNamibiaNauruNepalNetherlandsNetherlands AntillesNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorwayOmanPakistanPalauPanamaPapua Новый GuineaParaguayPhilippinesPitcairnPolandPortugalPuerto RicoQatarReunionRomaniaRussian FederationRwandaSaint HelenaSaint LuciaSamoaSan MarinoSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSpainSri LankaSudanSurinameSwazilandSwedenSwitzerlandSyrian Арабские RepublicTa iwanТайвань, провинция Китая, Тайвань, Китайская Республика, Таджикистан, Танзания, Таиланд, Того, Токела, Тонга, Тринидад и Тобаго, Тунис, Турция, Турция, Туркменистан, Тувалу, Уганда, Украина, Объединенные Арабские Эмираты, Соединенное Королевство, Соединенные Штаты, Уругвай, Узбекистан, Британские острова, Вануату, Вьетнам, Вирджиния, острова Вирджиния, Вьетнам, Вануату, Острова.с. Уоллис и Футуна, Западная Сахара, Йемен, Замбия, Зимбабве,
Пожалуйста, введите свой почтовый индекс Великобритании или выберите другую страну выше
Указанные цены являются приблизительными, исходя из покупки одного товара, в корзине которого больше ничего нет. Цены и опции не включают правила доставки и пошлины, которые будут проверены в процессе оформления заказа.
В CVP мы всегда стремимся доставить ваш заказ как можно быстрее, но в интересах ясности обратите внимание, что следующий день определяется как следующий рабочий день (т. Е. Исключая выходные, государственные праздники в Великобритании и праздничные дни).
Заказы, размещенные и прошедшие проверку безопасности до 14: 00GMT, когда все товары есть на складе, обычно будут отправлены в тот же рабочий день для окончательной доставки в соответствии с выбранным методом доставки.
Если товар физически отсутствует на складе, фактическое время доставки будет увеличено на время выполнения заказа для данного товара. Доставка на Нормандские острова, Северную Ирландию, Республику Ирландию и некоторые удаленные почтовые индексы Великобритании осуществляется не на следующий день, а через 2 рабочих дня.
Все транзакции проходят проверку безопасности CVP, которая предназначена для нашей взаимной защиты от кражи личных данных и мошенничества.В случае, если потребуются дополнительные проверки, вы будете проинформированы, и время отправки будет продлено на время, необходимое для решения любых возникших вопросов. Мы приносим извинения за все возможные неудобства.
* Из-за непредвиденных обстоятельств, в некоторых случаях отправка в тот же день может быть невозможна. В этом случае мы всегда будем делать все возможное, чтобы держать вас в курсе любых задержек.
Для получения дополнительной информации о доставке, пожалуйста, ознакомьтесь с разделом «Доставка и сбор» или с нашими Условиями. извлекли выгоду из определенного GENSAT набора бактериальных искусственных хромосом для маркировки определенных, генетически определенных типов клеток в головном мозге.Хотя бактериальные искусственные хромосомы имеют преимущества и недостатки (Dougherty, 2014; Ting and Feng, 2014), эти реагенты позволили профилировать многие типы клеток и остаются общедоступными (Таблица 1). Кроме того, были разработаны Cre-зависимые репортерные линии (таблица 2; рис. 1 B ), которые позволяют использовать TRAP для Cre-определенных типов клеток. Самым ранним репортером была мышь Ribotag (Sanz et al., 2009). Он отличается от традиционного TRAP тем, что генерирует Cre-зависимую HA-метку на эндогенном белке RPL22 (рис.2 А ). Хотя и GFP / RPL10A, и RPL22 / HA помечают большую субъединицу, различия в относительной стехиометрии и сродстве рибосом к меченным белкам, а также сродства антител могут приводить к различиям в производительности in vivo между конструкциями. Аналогичным образом недавняя работа показала, что RPL10A, по крайней мере, в ES-клетках, присутствует на субстехиометрических уровнях, а рибосомы, содержащие RPL10A, имеют измененное сродство к ~ 5% транскриптов (Shi et al., 2017). Хотя это вряд ли повлияет на сравнения между типами ячеек, все помеченные GFP / RPL10A, поскольку такие предубеждения должны нейтрализоваться; это может привести к интересным различиям между отдельными метками эпитопа.Таким образом, прямое сравнение представляло бы как научный, так и технический интерес. Множество репортерных линий, экспрессирующих GFP / RPL10A Cre-зависимым (Zhou et al., 2013; Liu et al., 2014) или Tet-зависимым (Drane et al., 2014) способом из Rosa26 или альтернативных локусов (Stanley et al., 2014) al., 2013), даже с альтернативными красными флуорофорами в качестве меток (Hupe et al., 2014).
Таблица 1.Список общедоступных линий bacTRAP a
Таблица 2.TRAP и связанные репортерные линии TRAP a
Рисунок 2.Альтернативные метки для очистки рибосом. Стандартный протокол TRAP (серый прямоугольник) может быть адаптирован для использования с различными рибосомными метками. A , Конструкция RPL10A / GFP маркирует большую (60S) субъединицу, которая не взаимодействует с мРНК до инициации трансляции. Таким образом, он не будет захватывать сканирующие частицы малых субъединиц (40S) до инициации, хотя он будет захватывать частицы 60S, не связанные с мРНК. B , HA-меченный белок L22 от мыши Ribotag также маркирует большую субъединицу и должен иметь аналогичные последствия. C , Белок S6 малой субъединицы фосфорилируется в ответ на активность. Таким образом, захват фосфо-S6 должен приводить к трансляции, а также к потенциально сканированию или остановке мРНК из активированных клеток. Предполагается, что захват мРНК из каждой клетки будет пропорционален количеству фосфорилирования S6 и, следовательно, активности. D , Мечение RPL10A с помощью нанотела (NB) против GFP позволяет превратить любой экспрессирующий GFP вирус или линию мыши в реагент TRAP.В этой системе растворимый GFP в клетке обеспечивает линкер для меченой рибосомы и гранулы анти-GFP. Однако, поскольку GFP является растворимым ex vivo , необходимо внимательно рассмотреть возможность блокирования избытка GFP.
Кроме того, конструкции TRAP достаточно малы для упаковки в аденоассоциированный вирус (рис. 1 C ). Сочетание Cre-зависимого дизайна FLEX и стереотаксической инъекции обеспечивает экспрессию в пространственно, временно и генетически ограниченных популяциях клеток (Nectow et al., 2017). Есть реальные преимущества доставки конструкций TRAP аденоассоциированным вирусом для многих типов клеток. Примечательно, что вирусная экспрессия занимает недели (по сравнению с месяцами для разведения мышей), а также может обойти хорошо известные проблемы с временной экспрессией Cre во многих линиях мышей.
Кроме того, вирусные конструкции допускают дополнительные инновации в нацеливании на типы клеток, основанные не только на специфической экспрессии Cre, но также потенциально на проекциях, местоположении и активности (рис.1). Например, упаковка капсидными белками, которые инфицируют аксоны в своих зонах-мишенях, позволяла молекулярное фенотипирование нейронов, проецируемых в определенные регионы (Cook-Snyder et al., 2015), или в сочетании с транссинаптическими вирусами, отображала входы дальше по течению (Ekstrand et al. ., 2014; Померанц и др., 2017). Зависимость экспрессии от зависимых от активности промоторов позволила молекулярное фенотипирование клеток, активируемых определенными стимулами (Ye et al., 2016). Еще один подход включает захват рибосом фосфорилированным белком S6 (рис.2), метка, которая может быть отложена на рибосомах в результате нейрональной активности (Knight et al., 2012). Эти «основанные на открытии» исследования, основанные на активности или прогнозе, контрастируют с исследованиями типов клеток-кандидатов, в которых целевой тип клеток выбирается априори по экспрессии маркерного гена. Таким образом, они требуют другого взгляда на анализ. Идентичность клетки, определяемая проекцией или активностью, может не иметь однозначного соответствия типу клетки, определяемому экспрессией гена. Например, Померанц и др. (2017) четко идентифицировали транскрипты, которые, как известно, экспрессируются во множестве разнородных типов клеток, на основании их проекций на VTA.Подходы, основанные на предшествующих молекулярных описаниях типов клеток, могут помочь интерпретировать эти результаты (Xu et al., 2014). Кроме того, поскольку TRAP является мерой совокупной экспрессии для всех типов помеченных клеток, вероятно, пропорционально их количеству, количеству рибосом и стехиометрии тега, только по результатам TRAPseq невозможно определить, присутствует ли транскрипт в подмножество или надмножество помеченных ячеек. Этот уровень неоднородности необходимо исследовать другими методами.
Помимо вирусов, конструкции TRAP также могут быть доставлены путем электропорации в определенные эпохи развития к типам клеток-мишеней в зависимости от даты рождения.Напр., Электропорация коры головного мозга крыс E16 позволила провести более поздний TRAP-анализ нокдауна Tcf4 в пирамидных нейронах слоя 2/3 (Rannals et al., 2016). Электропорацию также применяли для изучения синхронного развития гранулярных нейронов in vivo (Yang et al., 2016) (рис. 1 D ). Конечно, существующие линии TRAP также могут быть использованы для изучения конкретных окон развития при условии, что трансген EGFP / RPL10A активируется достаточно рано (X. Zhu et al., 2016).
Наконец, хотя этот обзор посвящен нервной системе млекопитающих, TRAP был адаптирован для таких разнообразных видов, как рыбки данио (Tryon et al., 2013), Drosophila (Thomas et al., 2012), Xenopus (Watson et al., 2012) и даже растения (Juntawong et al., 2015).
Очистка ядра для изучения эпигенетики и некодирующей РНК
Еще одно применение линий мышей, экспрессирующих EGFP / RPL10A, произошло из наблюдения, что рибосомы собраны в субядерную структуру: ядрышко. Для версий с флуоресцентной меткой этот сигнал разрешает FACS генетически меченых ядер (рис. 3 A ), позволяя профилировать по типу клеток как состояния хроматина (Kriaucionis and Heintz, 2009), так и прямые измерения ядерной РНК, что позволяет более непосредственно оценка транскрипции как мРНК, так и некодирующих видов РНК, таких как LINC и кольцевая РНК (Reddy et al., 2017). Поскольку рибосомы также покрывают ядерную мембрану, возможно, что ядра TRAP могут быть захвачены анти-GFP, подобно методу INTACT (Deal and Henikoff, 2010). Если эта комбинация эффективна, она могла бы позволить прямое сравнение цитоплазматической трансляции и ядерной транскрипции или статуса хроматина у одних и тех же мышей. Несмотря на это, сейчас также существуют репортерные мыши, которые отдельно маркируют рибосомы и ядра, что может еще больше упростить такие сравнения (Roh et al., 2017).
Рисунок 3.Адаптации TRAP для изучения субклеточной локализации РНК и регуляции трансляции.Дополнительные шаги могут быть вставлены в стандартный рабочий процесс TRAP (серые поля) для проведения новых исследований. A , GFP / RPL10A обнаруживается снаружи ядерной мембраны (так как она прилегает к эндоплазматической сети) и в ядрышках. Таким образом, простая ядерная фракция может быть отсортирована в потоке для сбора ядер, специфичных для определенного типа клеток, для ядерных RNAseq или эпигенетических исследований. Возможно, что возможна прямая аффинная очистка для GFP, как было показано для других ядерных меток в NuTRAP и INTACT. B , Ткань может быть предварительно фракционирована с использованием классических протоколов в определенные субклеточные компартменты на основе плотности для сбора частей клеток, обогащенных определенными заключенными в мембрану фрагментами, такими как фракции, содержащие синаптонейросомы (SNF), которые также содержат маркеры периферических астроцитов процессы. Затем фракции могут быть лизированы, и субклеточно локализованные рибосомы, специфичные для определенного типа клеток, могут быть захвачены с помощью TRAP. C . Аналогичным образом, для тех клеток, где дендриты находятся в пластинке, которые физически отделимы от тел клеток, микродиссекция позволяет TRAP на каждом слое независимо. D , рибосомы, содержащие TRAP, можно подвергнуть обработке РНКазой, чтобы оставить только те ∼30 нуклеотидных фрагментов, которые физически защищены рибосомой. Секвенирование этих «следов рибосом» (RF) позволяет анализировать использование конкретных ORF из каждой мРНК.
Оценка трансляции, специфичная для клеточного типа
Хотя TRAP использовался для изучения экспрессии генов, поскольку он включает захват рибосомы, он предоставляет уникальную возможность изучить регуляцию трансляции специфическим для клеточного типа образом in vivo .ЦНС обладает замечательной степенью регуляции трансляции, особенно субклеточно, где считается, что локальная трансляция новых белков около синапсов позволяет изменять локальные связи в ответ на локализованную активность (Rangaraju et al., 2017). Кроме того, параллельно с альтернативным сплайсингом, когда несколько изоформ мРНК образуются из одного гена, теперь признано, что использование альтернативной инициации, считывания стоп-кодонов, переключения кодонов и зашифрованных открытых рамок считывания (ORF) позволяет нескольким белкам объединяться. быть сделаны из той же изоформы мРНК (Ingolia, 2016).



 Документ оформляется на имя первого лица компании.
Документ оформляется на имя первого лица компании. Письму присваивается номер и дата, оно заверяется печатью учреждения и подписывается директором.
Письму присваивается номер и дата, оно заверяется печатью учреждения и подписывается директором. Также формируется приказной документ о приеме на должность посредством перевода из другого учреждения. Оформляется новая личная карточка.
Также формируется приказной документ о приеме на должность посредством перевода из другого учреждения. Оформляется новая личная карточка.
 E.E., M.K.F., Z.B., M.Z.W., M.L.D., Y.S.P., B.R. и K.S.K. проанализированные данные; и D.E.E., M.K.F., Z.B., M.Z.W., Y.S.P., B.R. и K.S.K. написал газету.
E.E., M.K.F., Z.B., M.Z.W., M.L.D., Y.S.P., B.R. и K.S.K. проанализированные данные; и D.E.E., M.K.F., Z.B., M.Z.W., Y.S.P., B.R. и K.S.K. написал газету.